-
(1)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中 所放出的热量可计 算中和热。回答下列问题:
算中和热。回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是__________________。
②实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH 溶液进行反应,与上述实验相比,所求的中和热_________(填“相等”或“不相等”)。
(2)①如图Ⅰ 表示10 mL量筒中液面的位置。A与B,B与C刻度间相差1 mL,如果刻度A为6,量筒中液体的体积是________mL。
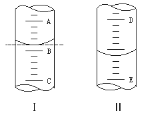
②图Ⅱ表示50 mL滴定管中液面的位置。如果液面处的读数是a,则滴定管中液体的体积(填代号)________。
A.是a mL B.一定大于a mL
C.是(50-a) mL D.一定大于(50-a) mL
(3)已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2 O4)氧化:
O4)氧化:
(i)MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
(ii)MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入1.80g草酸,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.020mol·L-1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。试回答下列问题:
① 方程式(i)配平后H2C2O4的计量系数为 。
② 0.020mol·L-1KMnO4标准溶液应置于 (填“甲”或“乙”)滴定管中;滴定终点的颜色变化是 。

③ 你能否帮助该研究小组求得软锰矿中MnO2的质量分数;若“能”,请给出计算结果;若“否”,试说明原因。“能”的计算结果或“否”的原因说明 。
④若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 。
A.滴定前尖嘴部分有一气泡,滴定终点时消失
B.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
C.滴定前仰视读数,滴定后俯视读数
D.定容时,俯视刻度线
E.锥形瓶水洗之后未用待测液润洗
-
50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
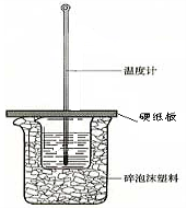
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”或“无影响”)。
(4)实验中60 mL0.50 mol/L盐酸与50 mL0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由:___________。
-
50 mL 0.50 mol·L−1盐酸与50 mL 0.55 mol·L−1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
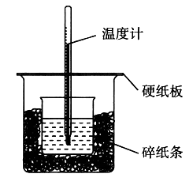
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填”偏大”“偏小”或”无影响”)。
(4)实验中改用60 mL 0.50 mol·L−1盐酸跟50 mL 0.55 mol·L−1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填”相等”或”不相等”),所求中和热__________(填”相等”或”不相等”),简述理由:_________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填”偏大”“偏小”或”无影响”,下同);用50 mL 0.50 mol·L−1 NaOH溶液进行上述实验,测得的中和热的数值会__________。
-
用50mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
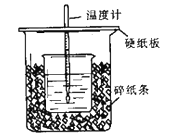
(1)观察实验装置,图中尚缺少的一种玻璃用品是__________。
(2)烧杯间填满碎纸条的作用是_________________________。
(3)大烧杯上口不盖硬纸板,测得的中和热数值 __________(填“偏大、偏小、无影响”)。
(4)实验中改用55mL 0.50 mol/L盐酸与55mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________ (填“相等、不相等”)。
(5)在中和热测定实验中,若用相同浓度和体积的氨水代替NaOH溶液进行实验,测得的中和热的数值会____(填“偏大”、“偏小”“不变”)原因是_____________。
-
50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________。
(2)烧杯间填满碎纸条的作用是_________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”“偏
小”“无影响” )。
(4)倒入NaOH溶液的正确操作是_________________________,使盐酸与NaOH溶液混合均匀的正确操作是___________________________。平行地做一次这样的实验需要测定_____次温度。
(5)三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为①2.3 ℃,②2.4 ℃,③2.9 ℃,则最终代入计算式的温度差的平均值为________ ℃。已知水的比热容为C为4.18J/(g·℃),稀盐酸和稀氢氧化钠溶液的密度别为ρ1、ρ2用量均为VmL,混合前溶液的平均温度为t1,混合溶液的最高温度为t2,则中和热ΔH=____________________ kJ/mol(请写出简化的代数式,否则不给分)。
(6)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”“不相等”),所求中和热________(填“相等”“不相等”),用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_______________。(填“偏大”“偏小”“无影响”)
-
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
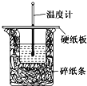
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________,烧杯间填满碎泡沫塑料的作用是________________________。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值__(填“偏大”、“偏小”或“无影响”)。
(3)实验中若改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热的数值______(填“相等”或“不相等”),理由是_______________________________。
(4)三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为2.3 ℃、2.4 ℃、2.9 ℃,则最终代入计算式的温度差的平均值为_____℃。
-
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎纸条的作用是________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”或“无影响”)。
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1 NaOH溶液各50 mL进行实验,其中NaOH溶液浓度大于盐酸浓度的作用是______,当室温低于10 ℃时进行实验,对实验结果会造成较大的误差,其原因是_____________。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求得的中和热________(填“相等”或“不相等”),简述理由: ______________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将________(填“偏大”、“偏小”或“无影响”)。
-
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎纸条的作用是________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”或“无影响”)。
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1 NaOH溶液各50 mL进行实验,其中NaOH溶液浓度大于盐酸浓度的作用是______,当室温低于10 ℃时进行实验,对实验结果会造成较大的误差,其原因是_____________。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求得的中和热________(填“相等”或“不相等”),简述理由: ______________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将________(填“偏大”、“偏小”或“无影响”)。
-
用50mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
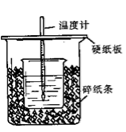
(1)观察实验装置,图中尚缺少的一种玻璃用品是__________。
(2)烧杯间填满碎纸条的作用是_________________________。
(3)大烧杯上如不盖硬纸板,测得的中和热数值 __________(填“偏大、偏小、无影响”)。
(4)实验中改用55mL 0.50 mol/L盐酸与55mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________ (填“相等、不相等”)。
(5)在中和热测定实验中,若用相同浓度和体积的氨水代替NaOH溶液进行实验,测得的中和热的数值会________ (填“偏大”、“偏小”“不变”)。
-
(I)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反 应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
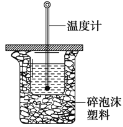
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值________(填“偏 大”、“偏小”或“无影响”);
(3)实验中改用60 mL 0.50 mol/L 盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由________________________________________________________。
(Ⅱ).某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(4)请完成以下实验设计表,并在实验目的一栏中填空:
| 实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究e_______对反应速率的影响 |
| ② | 25 | 粗颗粒 | a______ |
| ③ | b_______ | 粗颗粒 | 2.00 |
| ④ | c________ | 细颗粒 | d______ |
(5)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在O~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。

算中和热。回答下列问题:


O4)氧化:









