-
25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
-
25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
【答案】C
【解析】A、根据电离平衡常数知,酸性H2CO3>HCN>HCO3-,结合强酸制取弱酸知,氰化钠溶液中通入少量CO2只能发生以下反应CN﹣+H2O+CO2=HCN+ HCO3-,故A错误;B、NaCN溶液显碱性,HCN溶液显酸性,选项中没有已知混合时NaCN与HCN量的相对大小,无法判断溶液的酸碱性,也无法判断离子浓度大小,故B错误;C、HCN的电离常数K与CN−的水解常数Kh的乘积等于Kw,则有Kh= ≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN−)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN−)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
【题型】单选题
【结束】
19
室温下,向20.00 mL 0.8mol•L﹣1一元酸HA溶液中滴入0.8 mol•L﹣1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
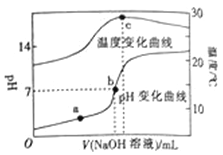
A. 常温下,1.0 mol•L﹣1HA的溶液的pH=0
B. a、b、c三点,a点混合溶液中c(Na+)最大
C. a、b两点的溶液中水的离子积Kw(a)=Kw(b)
D. c点时消耗NaOH溶液的体积为20.00mL
-
25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
【答案】C
【解析】A、根据电离平衡常数知,酸性H2CO3>HCN>HCO3-,结合强酸制取弱酸知,氰化钠溶液中通入少量CO2只能发生以下反应CN﹣+H2O+CO2=HCN+ HCO3-,故A错误;B、NaCN溶液显碱性,HCN溶液显酸性,选项中没有已知混合时NaCN与HCN量的相对大小,无法判断溶液的酸碱性,也无法判断离子浓度大小,故B错误;C、HCN的电离常数K与CN−的水解常数Kh的乘积等于Kw,则有Kh= ≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN−)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN−)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
【题型】单选题
【结束】
19
室温下,向20.00 mL 0.8mol•L﹣1一元酸HA溶液中滴入0.8 mol•L﹣1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
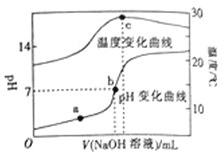
A. 常温下,1.0 mol•L﹣1HA的溶液的pH=0
B. a、b、c三点,a点混合溶液中c(Na+)最大
C. a、b两点的溶液中水的离子积Kw(a)=Kw(b)
D. c点时消耗NaOH溶液的体积为20.00mL
-
己知:
| 弱电解质 | 电离平衡常数(25℃) |
| 碳酸 | K1=4.3×10-7 K2=5.6×10-11 |
| 次氯酸 | K=3.0×10-8 |
| 氢氧化铝 | Ka =6.3×10-13 |
| 氢氰酸(HCN) | K=4.9×10-10 |
运用电离平衡常数判断不可以发生的反应有几个
①HClO+Na2CO3=NaClO+NaHCO3
②2HClO+Na2CO3=2NaClO+H2O+CO2↑
③HClO+NaHCO3=NaClO+H2O+CO2↑
④NaClO+CO2+H2O=NaHCO3+HClO
⑤HCO3-+AlO2-+H2O==Al(OH)3↓+CO32-
⑥NaCN+CO2+H2O=HCN+NaHCO3
A. 5 B. 4 C. 3 D. 2
-
己知:
| 弱电解质 | 电离平衡常数(25℃) |
| 碳酸 | K1=4.3×10-7 K2=5.6×10-11 |
| 次氯酸 | K=3.0×10-8 |
| 氢氧化铝 | Ka =6.3×10-13 |
| 氢氰酸(HCN) | K=4.9×10-10 |
运用电离平衡常数判断不可以发生的反应是( )
①HClO+Na2CO3=NaClO+NaHCO3
②2HClO+Na2CO3=2NaClO+H2O+CO2↑
③HClO+NaHCO3=NaClO+H2O+CO2↑
④ NaClO+CO2+H2O=NaHCO3+HClO
⑤HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
⑥NaCN+CO2+H2O=HCN+NaHCO3
A.②③⑤ B.②④⑥ C.①④⑤⑥ D.②③
-
己知:
| 弱电解质 | 电离平衡常数(25℃) |
| 碳酸 | K1=4.3×10-7 K2=5.6×10-11 |
| 次氯酸 | K=3.0×10-8 |
| 氢氧化铝 | Ka =6.3×10-13 |
| 氢氰酸(HCN) | K=4.9×10-10 |
运用电离平衡常数判断不可以发生的反应是( )
①HClO+Na2CO3=NaClO+NaHCO3
②2HClO+Na2CO3=2NaClO+H2O+CO2↑
③HClO+NaHCO3=NaClO+H2O+CO2↑
④ NaClO+CO2+H2O=NaHCO3+HClO
⑤HCO3-+AlO2-+H2O==Al(OH)3↓+CO32-
⑥NaCN+CO2+H2O=HCN+NaHCO3
A. ②③⑤ B. ②④⑥ C. ①④⑤⑥ D. ②③
-
(8分)
I. 已知在25℃时,HF、HCN和H2CO3的的电离平衡常数如表所示:
(1)写出碳酸的第一级电离平衡常数表达式:K1= 。
(2)①往Na2CO3溶液中加入足量HF溶液,发生反应的离子方程式:
②往NaCN溶液中通入少量CO2,发生反应的离子方程式:
II. 用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是________________________________________________________________________________________________________________________________ 。
-
(12分)已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
| ① | HF | Ka=6.8×10-4 mol•L-1 |
| ② | CH3COOH | Ka=1.7×10-5 mol•L-1 |
| ③ | HCN | Ka=6.2×10-10 mol•L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
根据上述数据,回答下列问题:
(1)四种酸中酸性最强的是_____________,四种酸中酸性最弱的是_____________。
(2)写出H2CO3电离方程式是________、________。
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合:_________________________,
足量的CO2通入NaCN溶液中:______________________。
-
已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
| ① | HF | Ka=6.8×10-4 mol•L-1 |
| ② | CH3COOH | Ka=1.7×10-5 mol•L-1 |
| ③ | HCN | Ka=6.2×10-10 mol•L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
根据上述数据,回答下列问题:
(1)四种酸中酸性最弱的是_____________________。
(2)写出H2CO3电离方程式是 。
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合: ______,少量的CO2通入NaCN溶液中: _____。
-
已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
| ① | HF | Ka=6.8×10-4mol•L-1 |
| ② | CH3COOH | Ka=1.7×10-5mol•L-1 |
| ③ | HCN | Ka=6.2×10-10mol•L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11mol•L-1 |
根据上述数据,回答下列问题:
(1)四种酸中酸性最强的是______,四种酸中酸性最弱的是______.
(2)写出H2CO3电离方程式是______、______.
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合:______.
≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN−)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。

