-
NaNO3是重要的化工原料,可通过下列方法制备:
第一步:在吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5%NO、1.5%NO2)
用纯碱溶液完全吸收。
第二步:将吸收塔中的混合液送入转化塔中,加入50%HNO3溶液,同时通入足量的压缩空气搅拌,充分反应,得到NaNO3和硝酸的混合液。
第三步:将转化塔中的混合液用纯碱中和后,经蒸发浓缩、冷却结晶、离心分离、干燥,得NaNO3成品。
已知:每生产1.0t纯净的NaNO3固体,需消耗0.65 t无水Na2CO3、消耗氧气的体积为33.6 m3(标准状况下)和一定量的HNO3。生产过程中排出的尾气中均不含氮氧化物。
回答下列问题:
(1) 第一步生产过程中发生反应的总化学方程式是 。
(2) 检验NaNO3成品中是否含少量的Na2CO3杂质的方法是
(3) 生产过程中Na2CO3的利用率是________(计算结果精确到小数点后两位)。
(4) 生产1.0 t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积为多少m3(标准状况下)。请写出计算过程。
高三化学填空题中等难度题查看答案及解析
-
硝酸是重要的化工原料,工业上用氨催化氧化法生产硝酸,反应如下:
①氧化炉:4NH3+5O2=4NO+6H2O
②吸收塔:4NO+3O2+2H2O=4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80。完成下列计算:
(1)1mol NH3完全转化为NO至少需要空气______mol。工业上先将氨气和空气混合好,在氧化炉反应后直接通入吸收塔中用冷水吸收,为了确保吸收效果,第②步反应要求氧气至少过量20%,计算起始时空气与氨气的体积比至少为______
(2)硝酸工业产生的氮氧化物尾气(NO和NO2),可用烧碱吸收,反应如下:
①NO+NO2+2NaOH=2NaNO2+H2O
②2NO2+2NaOH=NaNO3+NaNO2+H2O
现有含0.5mol氮氧化物的尾气,用8mol/L的NaOH溶液完全吸收,吸收后的溶液中c(OH﹣):c(NO2﹣):c(NO3﹣)=5:4:1。所用NaOH溶液的体积为______mL。若将尾气中NO与NO2的平均组成记为NOx,则x=______
(3)工业上用硝酸与氨气反应制取硝酸铵:HNO3+NH3=NH4NO3,反应时NH3的吸收率为97%,硝酸的利用率为98%。在用氨气制取硝酸时,氨气的利用率为90%。计算生产80吨的硝酸铵共需氨气__吨?(保留1位小数)
高三化学解答题困难题查看答案及解析
-
硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜。
已知:2NO2+2NaOH=NaNO3+ NaNO2+H2O ,NO+NO2+2NaOH=2NaNO2+H2O(以下涉及到的气体体积均为标准状况下数据):
(1)甲组用a克Cu粉,在加热的条件下,与空气充分反应,然后将生成的CuO全部溶于VmL稀硝酸中,制得硝酸铜溶液,则所需稀硝酸的浓度至少为_______mol/L,需要质量分数为ω%,密度为ρg/cm3的浓硝酸_______mL(均用最简分式表示)。
(2)乙组用b克Cu粉,全部溶于过量的稀硝酸中,溶液质量增重_____克,将生成的气体通入足量NaOH溶液中并同时通入氧气的体积至少_______L才能使生成的气体吸收完全(均用最简分式表示)。
(3)丙组取某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。列式计算原混合酸中硝酸的物质的量是多少?____________硫酸的物质的量浓度多少?_________
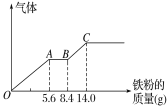
高三化学计算题中等难度题查看答案及解析
-
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。
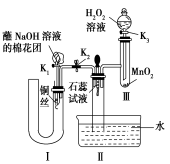
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至 后,迅速关闭K1,观察到U形管内的现象是 。
②装置Ⅲ中发生反应的化学方程式为 。
③蘸NaOH溶液的棉花团的作用是 。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO 。
高三化学填空题困难题查看答案及解析
-
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:___________________________________________。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。
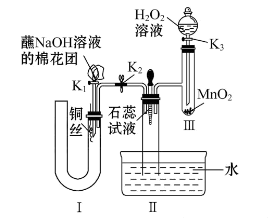
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至____________后,迅速关闭K1,观察到U形管内的现象是_______________________________________________________________。
②装置Ⅲ中发生反应的化学方程式为__________________________________。
③蘸NaOH溶液的棉花团的作用是_______________________________________。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO________________________________。
高三化学简答题困难题查看答案及解析
-
硝酸工业生产中的尾气(NO2、NO的混合气体)通常可用纯碱溶液吸收:
2NO2+Na2CO3→NaNO3+NaNO2+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
(1)在硝酸工业尾气吸收过程中,在标准状况下,每生成44.8L二氧化碳气体,可以吸收尾气________L。
(2)若工业上用21.2%的纯碱溶液吸收硝酸生产中的尾气时,若要配制10 kg该浓度的纯碱溶液,需要纯碱(Na2CO3·10H2O)质量是多少?
(3)要保证硝酸工业的尾气充分吸收,n(NO2)与n(NO)应满足何种关系?
(4)现有10 kg 21.2%的纯碱溶液,用于吸收NO2、NO,在标准状况下每产生448L二氧化碳时,纯碱溶液增重880 g。
①则生成NaNO3与NaNO2的质量比是多少?
②20℃时,10 kg 21.2%的纯碱溶液吸收完全后,蒸发掉6.88 kg水,冷却到5℃,可析出NaNO2晶体质量是多少?(已知5℃时,NaNO2 的溶解度为71.2g/100g水。忽略NaNO3的影响)。
高三化学计算题中等难度题查看答案及解析
-
工业上利用氨催化氧化后,经过一系列反应可以制备硝酸。
(1)氨气催化氧化的化学方程式为_
(2)某工厂排出的尾气中NOx的含量为0.56%(体积分数),用氨气可以将其转化为无害气体,发生的反应为:6NOx+4xNH3=(3+2x)N2+6xH2O 若处理1×
L(标准状况)该尾气需42.5gNH3,则x=_ 。
(3)NO和CO都是汽车尾气中的有害物质,必须进行处理。为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。写出净化过程中的总化学反应方程式:________。
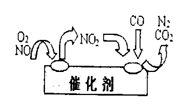
高三化学填空题中等难度题查看答案及解析
-
(10分)硝酸工业生产中的尾气(NO2、NO的混合气体)通常可用纯碱溶液吸收:
2NO2+Na2CO3→NaNO3+NaNO2+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
(1)在硝酸工业尾气吸收过程中,在标准状况下,每生成44.8L二氧化碳气体,可以吸收尾气________L。
(2)若工业上用21.2%的纯碱溶液吸收硝酸生产中的尾气时,若要配制10 kg该浓度的纯碱溶液,需要纯碱(Na2CO3·10H2O)质量是多少?
(3)要保证硝酸工业的尾气充分吸收,n(NO2)与n(NO)应满足何种关系?
(4)现有10 kg 21.2%的纯碱溶液,用于吸收NO2、NO,在标准状况下每产生448L二氧化碳时,纯碱溶液增重880 g。
①则生成NaNO3与NaNO2的质量比是多少?
②20℃时,10 kg 21.2%的纯碱溶液吸收完全后,蒸发掉6.88 kg水,冷却到5℃,可析出NaNO2晶体质量是多少?(已知5℃时,NaNO2 的溶解度为71.2g/100g水。忽略NaNO3的影响)。
高三化学计算题简单题查看答案及解析
-
硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
⑴ 根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加___________g。
⑵配制1000g 质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O________g。
⑶ 现有1000g 质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况下)CO2时,吸收液质量就增加44g。
①吸收液中NaNO2 和NaNO3 的物质的量之比________
② 1000g 质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2________克(0℃时,NaNO2的溶解度为71.2g/100g水)
高三化学填空题简单题查看答案及解析
-
硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3→NaNO2+NaNO3+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
(1)根据反应①,每产生22.4 L(标准状况下)CO2,吸收液质量将增加_____________g。
(2)配制1000 g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O_____________g。
(3)现有1000 g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4 L(标准状况)CO2时,吸收液质量就增加44 g。
① 计算吸收液中NaNO2和NaNO3物质的量之比。
② 1000 g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688 g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
高三化学计算题中等难度题查看答案及解析