-
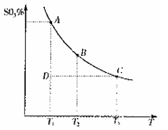
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为: ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
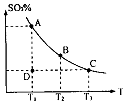
①反应 ________0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强________(填“增大”、“减小”或“不变”),平衡________移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量__________(填“增大”、“减小”或“不变”),O2的物质的量浓度________(填“增大”、“减小”或“不变”)。
________0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强________(填“增大”、“减小”或“不变”),平衡________移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量__________(填“增大”、“减小”或“不变”),O2的物质的量浓度________(填“增大”、“减小”或“不变”)。
②若温度为T1、 T2,反应的平衡常数分别为K1、K2 则K1________K2(填“>”、“<”或“=”),反应进行到D点状态时,V正________V逆(填“>”、“<”或“=”)
③在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10 mol O2,在500℃开始反应,半分钟达到平衡,测得容器内含SO3 0.18 mol,则v(O2)=________mol·L-1·min-1,若继续通入0.20 mol SO2和0.10 mol O2,平衡发生了移动,再次达到平衡后, ________mol<n(SO3)<________mol.
(2)已知三种无色溶液:a.NaHCO3溶液,b.AlCl3溶液,c.NaAlO2溶液,它们两两反应均能生成Al(OH)3沉淀。请回答下列问题:
①两种溶液恰好完全反应,所得溶液中c(OH—)= 是水的离子积),则这两种溶液可为________(填字母)。
是水的离子积),则这两种溶液可为________(填字母)。
②能体现出NaHCO3在反应中,HCO—3的水解程度小于电离程度的离于方程式为________。
-
运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。

①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v正________(填“>”“<”或“=”)v逆。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g) 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10 min内该反应的平均速率v(H2)=________。从第11 min起,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填编号)。
-
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)⇌2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
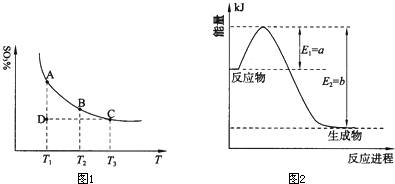
①2SO2(g)+O2(g)⇌2SO3(g)的△H______0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡______移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1______K2;若反应进行到状态D时,v正______v逆(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:______.(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4)______c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式______.
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.在25℃下,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是______,向反应后的浊液中,继续加入0.1mol•L-1的NaI溶液,看到的现象是______,产生该现象的原因是(用离子方程式表示)______.
-
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H________0(填“>”或“<”);若在恒温、
2SO3(g)的△H________0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
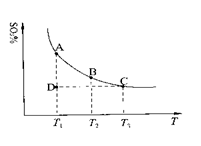
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1________K2;若反应进行到状态D时, ________
________ (填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
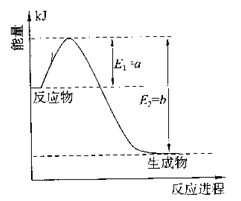
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,
请写出工业合成氨的热化学反应方程式:________。
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水。在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4)________c(Cl-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数________。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是________,产生该现象的原因是(用离子方程式表示)________。
(已知25°C时 )
)
-
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)⇌2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
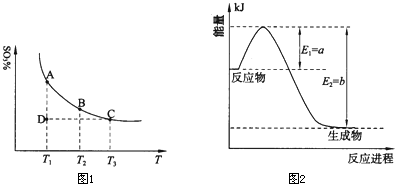
①2SO2(g)+O2(g)⇌2SO3(g)的△H______0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡______移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1______K2;若反应进行到状态D时,v正______v逆(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:______.(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4)______c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式______.
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.在25℃下,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是______,向反应后的浊液中,继续加入0.1mol•L-1的NaI溶液,看到的现象是______,产生该现象的原因是(用离子方程式表示)______.
-
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
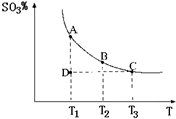
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)是______反应(填吸热或放热);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡______移动(填“向左”、“向右”或“不”);②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1______K2;若反应进行到状态D时,V正______V逆(填“>”、“<”或“=”)
2SO3(g)是______反应(填吸热或放热);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡______移动(填“向左”、“向右”或“不”);②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1______K2;若反应进行到状态D时,V正______V逆(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
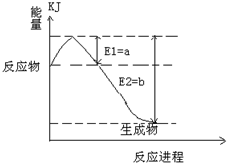
①如图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
______.(热量Q的数值用含字母a、b的代数式表示)
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.在25°C下,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol•L-1的NaI溶液,看到的现象是______,产生该现象的原因是(用离子方程式表示)______.
-
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
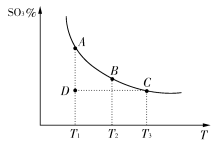
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)  2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)2SO2(g)+O2(g)  2SO3(g)的ΔH________0(填“>”或“<”);若在恒温;恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不”);
2SO3(g)的ΔH________0(填“>”或“<”);若在恒温;恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不”);
(2)若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1________K2;若反应进行到状态D时,v正________v逆(填“>”“<”或“=”);
-
(13分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:
 混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①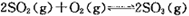 的△H 0(填“>”
的△H 0(填“>”
或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,
平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,
则K1________K2;反应进行到状 态D时,V正v逆(填“>”、“<”或“=)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业
生产、生活中有着重要作用。
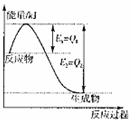
① 图是一定的温度和压强下是N2和H2反应生成1molNH3过
程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
。(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与
b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则
c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示该混合溶液中一水合出氨的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。已知:25℃时,KSP(AgCl)=1.6×10-10mol2·L-2、KSP(AgI)=1.5×10-16mol·L-2,在25℃下,向100mL 0.002mol·L-1的NaCl溶液中逐滴加入100mL 0.002mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
-
(14分)已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好。
(1)硫酸生产中,SO2催化氧化生成SO3,反应混合体系
中SO3的百分含量和温度的关系如右图所示(曲线上
点均为平衡状态)。由图可知:
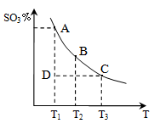
①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
②若温度为T1时,反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”);
③硫酸厂的SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为 、 ;
④新型氨法烟气脱硫技术是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。其优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为:________(只要求写一种);
(2)汽车尾气(含有烃类、CO、NOx等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。其前半部反应方程式为:
2CO+2NO  2CO2+N2。它的优点是 ;
2CO2+N2。它的优点是 ;
(3)有人设想用图所示装置,运用电化学原理将CO2、SO2转
化为重要化工原料。
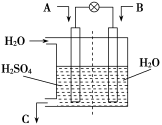
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为
;
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟
从C处获得100 mL 10 mol/L H2SO4,则A处通入烟气(SO2
的体积分数为1%)的速率为 L/min(标准状况)。
-
工业生产硫酸中二氧化硫的催化氧化原理为:2SO2(g)+O2(g) 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )
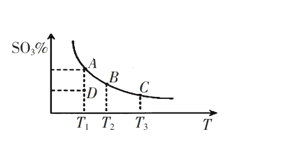
A. 在A、B、C三点时,V(正)=v(逆),在D点时V(正)>v(逆)
B. A、B、C三点的平衡常数一定不相同
C. 升高温度可以加快化学反应速率,有利于平衡向正反应方向移动
D. 一定温度下,保持容器体积不变,向平衡体系中通入稀有气体,压强增大,平衡不移动
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:

________0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强________(填“增大”、“减小”或“不变”),平衡________移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量__________(填“增大”、“减小”或“不变”),O2的物质的量浓度________(填“增大”、“减小”或“不变”)。
是水的离子积),则这两种溶液可为________(填字母)。








 混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
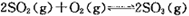 的△H
的△H


