-
(18分)电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用。按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
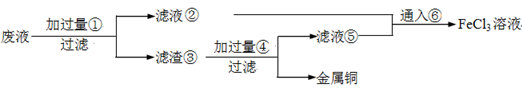
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:________。
(2)检验废腐蚀液中含有Fe3+的实验操作是________
(3)“过滤”用到的玻璃仪器有:普通漏斗、________。
(4)废液中加入过量①后,发生反应的离子方程式:
(5)上述流程中取废液200 mL,其中含CuCl2 1.5 mol·L—1、FeCl2 3.0 mol·L—1、FeCl3 1.0 mol·L—1,若要将铜全部回收,需加入Fe粉的质量应不少于_____________g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于_______________mol。
(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
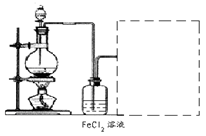
制备Cl2的化学方程式为:
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂。
-
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用。按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
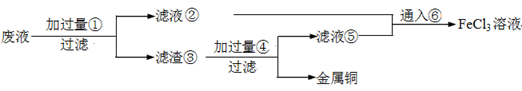
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:。
(2)检验废腐蚀液中含有Fe3+的实验操作是________
(3)“过滤”用到的玻璃仪器有:普通漏斗、________。
(4)废液中加入过量①后,发生反应的离子方程式:________
(5)上述流程中取废液200 mL,其中含CuCl2 1.5 mol·L—1、FeCl2 3.0 mol·L—1、FeCl3 1.0 mol·L—1,若要将铜全部回收,需加入Fe粉的质量应不少于_____________g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于_______________mol。
(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
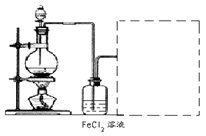
制备Cl2的化学方程式为:________
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂。
-
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用.按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.
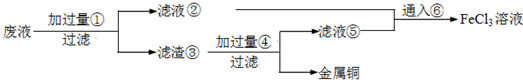
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:______.
(2)检验废腐蚀液中含有Fe3+的实验操作是______.
(3)“过滤”用到的玻璃仪器有:普通漏斗、______.
(4)废液中加入过量①后,发生反应的离子方程式:______.
(5)上述流程中取废液200mL,其中含CuCl2 1.5mol•L-1、FeCl2 3.0mol•L-1、FeCl3 1.0mol•L-1,若要将铜全部回收,需加入Fe粉的质量应不少于______g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于______mol.
-
电子工业常用 的
的 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
 写出该反应的化学方程式______。
写出该反应的化学方程式______。
 检验溶液少量
检验溶液少量 存在的试剂是______,证明
存在的试剂是______,证明 存在的现象是______。
存在的现象是______。
 印刷电路的废腐蚀液含有大量
印刷电路的废腐蚀液含有大量 、
、 、
、 ,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为
,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为 溶液,作为腐蚀液原料循环使用。
溶液,作为腐蚀液原料循环使用。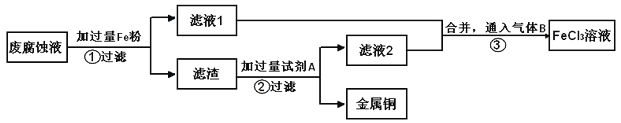
Ⅰ步骤①中发生反应的离子方程式______,______,若废腐蚀液中含有 、
、 、
、 ,若要将铜全部回收,则步骤
,若要将铜全部回收,则步骤
①应加入铁粉的质量应不少于______。
Ⅱ步骤②需加入的试剂A是______。
Ⅲ步骤③通入的气体B是______,写出该反应的离子方程式______。 步骤③溶液颜色变化______。 滤液2中加入氢氧化钠溶液的现象为______,发生反应的方程式为______,______,______。
-
(6分)
电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。
现将一块敷有铜箔的绝缘板浸入8.00×102 mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积变化)中取出20.00mL,向其中滴入
3.00mol • L-1AgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请计算:
(1)溶液A中FeCl3的物质的量浓度为___________________;
(2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于________________;
(3)讨论当剩余固体的组成不同时m与n可能的取值范围,并填入下表
| 剩余固体的组成 | m的取值范围 | n的取值范围 |
| 只有铜 | | |
| 有铁且有铜 | | (用含m的代数式表示) |
-
(10分)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是 ,证明Fe3+存在的现象是 。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式: 。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
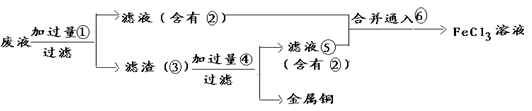
①请写出上述实验中③的化学式:
②配制并保存硫酸亚铁溶液时,常在其中加入
③要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为 。
①加入足量氯水 ②加入足量 溶液 ③加入少量KSCN溶液
溶液 ③加入少量KSCN溶液
A、①③ B、③② C、③① D、①②③
④写出向②⑤的合并液中通入⑥的离子方程式
-
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤:
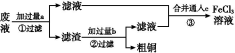
写出一个能证明还原性Fe比Cu强的离子方程式: 。
该反应在上图步骤 中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。
上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及主要的电极反应式 。
-
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H=。
Fe(s)+CO2(g) △H=。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为________。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。
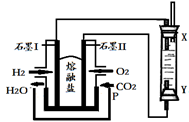
①石墨I电极上的电极反应式为 ________。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是(填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作为电解液
C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为 ________,该反应的化学方程式为________。
-
铁元素及其化合物与人类的生产生活息息相关,
试回答下列问题:
(1)电子工业常用30%,的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出该反应的离子方程式______.
(2)高炉炼铁过程中会发生反应:FeO(s)+CO(g)⇌Fe(s)+CO2(g).
已知:Fe(s)+ O2(g)═FeO(s)△H=-272kJ•mol-1
O2(g)═FeO(s)△H=-272kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-22lkJ•mol-1
则:①FeO(s)+CO(g)⇌Fe(s)+CO2(g)△H=______.
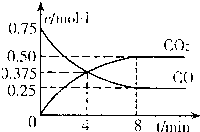
②一定温度下,向某密闭容器中加人足量FeO,并充人一定量的CO气体,反应过程中CO和CO2的浓度与时间的关系如图所示
则从开始至达到平衡过程中,v(CO)=______;该温 度下,FeO(s)+CO(g)⇌Fe(s)+CO2(g)的化学平衡常数K=______.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol•L-1盐酸中,再加人一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为______.
-
电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。现将一块敷有铜箔的绝缘板没入500mL某浓度FeCl3溶液中,一段时间后,将该线路板取出,向所得溶液中加入一定量的铁粉,充分反应后有固体剩余;将固体滤出并从滤液中取出20.00mL,向其中滴入2.00mol/LAgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请回答下列有关问题(忽略反应前后溶液体积的变化):
(1)原FeCl3溶液的物质的量浓度为_____________________。
(2)假若剩余固体中有铁粉,则向溶液中加入的铁粉质量至少应当大于_______________________。









