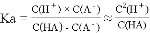-
T℃,分别向10ml浓度均为1mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH) 与溶液浓度的对数(1gc) 的关系如图所示。下列叙述正确的是
己知:(1)HA的电离平衡常数Ka=[c(H+)·c(A-)]/[c(HA)-c(A-)]≈c2(H+)/c(HA);(2) pKa=-lgKa

A.弱酸的Ka随溶液浓度的降低而增大
B.a 点对应的溶液中c(HA)=0.1mol/L,pH=4
C.酸性:HA<HB
D.弱酸HB的 pKa=5
-
T℃,分别向10ml浓度均为1mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH) 与溶液浓度的对数(1gc) 的关系如图所示。下列叙述正确的是
己知:(1)HA的电离平衡常数Ka=[c(H+)·c(A-)]/[c(HA)-c(A-)]≈c2(H+)/c(HA);(2) pKa=-lgKa

A. 弱酸的Ka随溶液浓度的降低而增大
B. a 点对应的溶液中c(HA)=0.1mol/L,pH=4
C. 酸性:HA<HB
D. 弱酸HB的 pKa=5
-
T℃,分别向10 mL浓度均为1 的两种弱酸HA,HB中不断加水稀释,并用pH传感器测定溶液
的两种弱酸HA,HB中不断加水稀释,并用pH传感器测定溶液 。所得溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系如图所示。已知:pKa=-lgKa,下列叙述正确的是( )
。所得溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系如图所示。已知:pKa=-lgKa,下列叙述正确的是( )
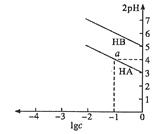
A.弱酸的Ka随溶液浓度的降低而增大
B.a点对应的溶液中c(HA)=0.1mol/L,pH=4
C.弱酸 的pK≈5
的pK≈5
D.酸性: HA<HB
-
T ℃,分别向10 mL浓度均为1 mol·L-1的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系如图所示。已知:pKa=-lgKa,下列叙述正确的是
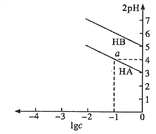
A. 弱酸的Ka随溶液浓度的降低而增大
B. a点对应的溶液中c(HA)=0.1 mol·L-1,pH=4
C. 弱酸HB的pKa≈5
D. 酸性:HA<HB
-
T℃时,浓度均为1mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系如图所示。下列叙述错误的是
已知:①HA的电离平衡常数: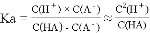
②pKa=-lgKa
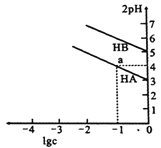
A. 酸性:HA>HB
B. a点对应的溶液中:c(HA)=0.1mol/L,c(H+)=0.01mol/L
C. T℃时,弱酸HB的pKa≈5
D. 弱酸的Ka随溶液浓度的降低而增大
-
常温时,浓度均为1mol·L-1的CH3NH2和NH2OH两种碱溶液,起始时的体积都为10mL。分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lg[c(OH-)]。下列说法正确的是( )

A.当两溶液均稀释至lg =5时,溶液中水的电离程度:NH2OH<CH3NH2
=5时,溶液中水的电离程度:NH2OH<CH3NH2
B.常温下,用盐酸滴定NH2OH时,可用酚酞作指示剂
C.CH3NH3Cl溶液中存在关系:2c(H+)+c(CH3NH)=c(CH3NH2)+2c(OH-)+c(Cl-)
D.等浓度的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系为:c(NH3OH+)>c(CH3NH+)
-
常温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得变化关系如图所示(V表示溶液稀释后的体积)。下列说法错误的是
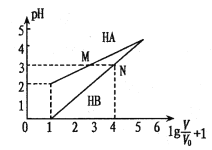
A. Ka( HA)约为10-4
B. 当两溶液均稀释至 时,溶液中
时,溶液中 >
>
C. 中和等体积pH相同的两种酸所用n(NaOH):HA>HB
D. 等体积、等物质的量浓度的NaA和NaB溶液中离子总数前者小于后者
-
常温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得变化关系如图所示(V表示溶液稀释后的体积)。下列说法错误的是

A.Ka( HA)约为10-4
B.当两溶液均稀释至 时,溶液中
时,溶液中 >
>
C.中和等体积pH相同的两种酸所用n(NaOH):HA>HB
D.等体积、等物质的量浓度的NaA和NaB溶液中离子总数前者小于后者
-
常温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得变化关系如图所示(V表示溶液稀释后的体积)。下列说法错误的是
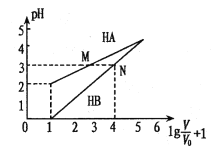
A.Ka( HA)约为10-4
B.当两溶液均稀释至 时,溶液中
时,溶液中 >
>
C.中和等体积pH相同的两种酸所用n(NaOH):HA>HB
D.等体积、等物质的量浓度的NaA和NaB溶液中离子总数前者小于后者
-
次磷酸(H3PO2一元弱酸)和氟硼酸(HBF4)均可用于植物杀菌。常温时,有1mol∙L-1的H3PO2溶液和1mol∙L-1的HBF4溶液,两者起始时的体积均为V0,分别向两溶液中加水,稀释后溶液的体积均为V,两溶液的pH变化曲线如图所示。下列说法错误的是

A.常温下,NaBF4溶液的pH=7
B.常温下,H3PO2的电离平衡常数约为1.1 10-2
10-2
C.NaH2PO2 溶液中:c(Na+) =c( H2PO2- ) +c( HPO22-) +c(PO23-) +c( H3PO2)
D.常温下,在0≤pH≤4时,HBF4溶液满足