-
在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),ΔH<0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g),ΔH<0,反应中CO2的浓度随时间变化情况如右图:
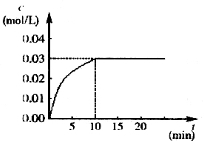
(1)根据图中数据计算反应开始至达到平衡时CO的化学反应速率为v(CO)= ;若升高温度,则化学平衡常数K (填“增大”“减小”或“不变”)。
(2)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应CO(g)+H2O(g)  CO2(g)+H2(g)向 (填“正反应”或“逆反应”)方向进行,其依据是 。反应达平衡时,c(H2O)= 。
CO2(g)+H2(g)向 (填“正反应”或“逆反应”)方向进行,其依据是 。反应达平衡时,c(H2O)= 。
-
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:
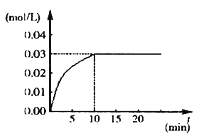
(1)根据上图数据,反应开始至达到平衡时,CO2的化学反应速率为v(CO2)=___mol/(L•min);反应达平衡时,c(H2O)=___ mol/L,该温度下的平衡常数K=___ .
(2)判断该反应达到平衡的依据是___ .
①正、逆反应速率都为零
②CO减少的化学反应速率和CO2减少的化学反应速率相等
③CO、H2O、CO2、H2的浓度都相等
④CO、H2O、CO2、H2的浓度都不再发生变化
(3)如要一开始加入0.1mol的CO、0.1mol的H2O、0.1mol的CO2和0.1mol的H2,在相同的条件下,反应达平衡时,c(H2)=___mol/L.
【答案】 0.03 0.01 9 ②④ 0.03
【解析】(1)根据
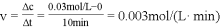
由图知道平衡时二氧化碳的浓度为0.03mol/L,则反应消耗H2O的浓度0.03mol/L,平衡时H2O的浓度为:0.2mol/5L−0.03mol/L=0.01mol/L;
根据三段式:CO(g)+H2O(g)⇌CO2(g)+H2(g)
起始量(mol/L)0.04 0.04 0 0
转化量(mol/L)0.03 0.03 0.03 0.03
平衡量(mol/L)0.01 0.01 0.03 0.03
则平衡常数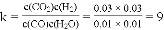
故答案为:0.03; 0.01; 9;
(2)①正、逆反应速率都为零,该反应没有开始,所以一定没有达到平衡状态,故错误;②CO减小的化学反应速率和CO2减小的化学反应速率相等,正逆反应速率相等,该反应达到平衡状态,故正确;③CO、H2O、CO2、H2的浓度都相等,该反应不一定达到平衡状态,与反应物初始浓度及转化率有关,故错误;④CO、H2O、CO2、H2的浓度都不再发生变化,该反应正逆反应速率相等,达到平衡状态,故正确。故答案为:②④;
(3)如果一开始加入0.1mol的CO、0.1mol的H2O、0.1mol的CO2和0.1mol的H2,与开始时加入0.3molCO和0.3molH2O为等效平衡,则两种条件下,达到平衡状态时其H2的物质的量浓度相等,所以达到平衡状态时,c(H2)=0.03mol/L;故答案为:0.03。
【题型】综合题
【结束】
28
下图是实验室制备溴乙烷的装置(已知溴乙烷的沸点38.4℃)。步骤如下:
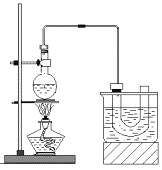
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在园底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
已知:NaBr+H2SO4=HBr+NaHSO4
请回答下列问题:
(1)写出烧瓶中制备溴乙烷的化学方程式_______________________________________。
(2)溴乙烷的水溶性_____________(填“大于”“等于”或“小于”)乙醇的水溶性,其原因是_________________________________。
(3)反应时若温度过高,会有副反应发生,写出相应的化学方程式___________________________。(任写一个)
(4)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_________________(填序号)
A.H2O B.Na2SO3溶液 C.CCl4 D.NaOH溶液
除杂所需的主要玻璃仪器是______________(填仪器名称)。
(5)检验溴乙烷中溴元素:取少量溴乙烷,然后__________________(氨正确的操作顺序填序号)。
①加热; ②加入AgNO3溶液; ③加入稀HNO3酸化; ④冷却; ⑤加入NaOH溶液
【答案】 CH3CH2OH+HBr CH3CH2Br+H2O 小于 乙醇可与H2O分子间形成氢键,而溴乙烷不能 CH3CH2OH
CH3CH2Br+H2O 小于 乙醇可与H2O分子间形成氢键,而溴乙烷不能 CH3CH2OH CH2=CH2+H2O或2CH3CH2OH
CH2=CH2+H2O或2CH3CH2OH CH3CH2OCH2CH3+H2O b 分液漏斗 ⑤①④③②
CH3CH2OCH2CH3+H2O b 分液漏斗 ⑤①④③②
【解析】(1)溴化钠、浓硫酸混合加热生成溴化氢,溴化氢和乙醇制取溴乙烷的化学方程式为CH3CH2OH+HBr CH3CH2Br+H2O;(2)由于乙醇可与H2O分子间形成氢键,而溴乙烷不能,所以溴乙烷的水溶性小于乙醇的水溶性;(3)温度过高会产生乙烯或乙醚,即CH3CH2OH
CH3CH2Br+H2O;(2)由于乙醇可与H2O分子间形成氢键,而溴乙烷不能,所以溴乙烷的水溶性小于乙醇的水溶性;(3)温度过高会产生乙烯或乙醚,即CH3CH2OH CH2=CH2↑+H2O或2CH3CH2OH
CH2=CH2↑+H2O或2CH3CH2OH CH3CH2OCH2CH3+H2O;(4)粗制的C2H5Br呈棕黄色,说明含有单质溴杂质,则,A.溴在溴乙烷中的溶解度比在水中大,加水难以除去溴乙烷中的溴,A错误;B.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,B正确;C.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,C错误;D.溴乙烷能够与氢氧化钠反应,D错误;答案选B;分液使用的主要仪器是分液漏斗;(5)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为⑤①④③②。
CH3CH2OCH2CH3+H2O;(4)粗制的C2H5Br呈棕黄色,说明含有单质溴杂质,则,A.溴在溴乙烷中的溶解度比在水中大,加水难以除去溴乙烷中的溴,A错误;B.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,B正确;C.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,C错误;D.溴乙烷能够与氢氧化钠反应,D错误;答案选B;分液使用的主要仪器是分液漏斗;(5)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为⑤①④③②。
【题型】实验题
【结束】
29
已知X是一种具有果香味的合成香料,下图为合成X的某种流程:
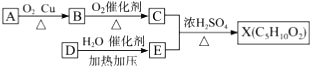
提示:① 不能最终被氧化为-COOH;
不能最终被氧化为-COOH;
②D的产量可以用来衡量一个国家的石油化工水平。
请根据以上信息,回答下列问题:
(1)D与C分子中官能团的名称分别是____________,E的结构简式是____________。
(2)D→E的化学反应类型为____________反应。
(3)上述A、B、C、D、E、X六种物质中,互为同系物的是____________。
(4)反应C+E→X的化学方程式为___________________________________________。
(5)反应B→C的化学方程式为_______________________。
-
Ⅰ在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如 下图:
下图:
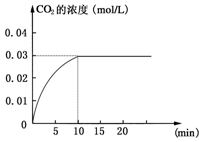
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=________ mol/L,该温度下的平衡常数K 。
(2) 判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
Ⅱ、在含有I-、Cl-的混合溶液中,逐滴加入一定量AgNO3溶液,当AgCl开始沉淀时,溶液中 为:___________,已知Ksp(
为:___________,已知Ksp( AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
-
.已知在一定条件下有CO(g)+H2O(g)  CO2(g)+H2(g),在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)
CO2(g)+H2(g),在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=a kJ/mol,反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
CO2(g)+H2(g) ΔH=a kJ/mol,反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
A.反应放出的热量为0.04a KJ
B.平衡时H2O的转化率为40%
C.若将容器的体积压缩为1 L,有利于该反应平衡正向移动
D.判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等
-
.已知在一定条件下有CO(g)+H2O(g)  CO2(g)+H2(g),在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)
CO2(g)+H2(g),在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=a kJ/mol,反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
CO2(g)+H2(g) ΔH=a kJ/mol,反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
A.反应放出的热量为0.04a KJ
B.平衡时H2O的转化率为40%
C.若将容器的体积压缩为1 L,有利于该反应平衡正向移动
D.判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等
-
在某一个容积为2L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H=akJ/mol(a>0) 达到平衡后,测得c(CO):c(CO2)=3:2.下列说法正确的是( )
CO2(g)+H2(g) △H=akJ/mol(a>0) 达到平衡后,测得c(CO):c(CO2)=3:2.下列说法正确的是( )
A.反应放出的热量为0.2akJ
B.平衡时H2O的转化率为40%
C.升高温度,v(正)加快v(逆)减慢,平衡正向移动
D.将容器的体积压缩为1L,该平衡正向移动
-
在某一个容积为2L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g)△H=akJ/mol(a>0)达到平衡后,测得c(CO):c(CO2)=3:2.下列说法正确的是
CO2(g)+H2(g)△H=akJ/mol(a>0)达到平衡后,测得c(CO):c(CO2)=3:2.下列说法正确的是
A.反应放出的热量为0.2akJ
B.平衡时H2O的转化率为40%
C.升高温度,v(正)加快v(逆)减慢,平衡正向移动
D.将容器的体积压缩为1L,该平衡正向移动
-
在某一容积为2L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g);ΔH=a kJ/mol(a>0),反应达到平衡后,测得c(CO):c(CO2)=3:2。下列说法正确的是
CO2(g)+H2(g);ΔH=a kJ/mol(a>0),反应达到平衡后,测得c(CO):c(CO2)=3:2。下列说法正确的是
A.反应放出的热量为0.2a kJ
B.平衡时H2O的转化率为40%
C.若升高温度,v(正)加快,v(逆)减慢,平衡正向移动
D.若将容器的体积压缩为1L,有利于该反应平衡正向移动
-
在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=—a kJ/mol(a>0),反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
CO2(g)+H2(g) ΔH=—a kJ/mol(a>0),反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
A.反应放出的热量为0.04a kJ
B.若将容器的体积压缩为1 L,有利于该平衡正向移动
C.平衡时H2O的转化率为40%
D.CO、H2O、CO2、H2的浓度都相等时反应达到平衡
-
CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ、在某一容积为5 L的体积不变的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:

(1)根据图上数据,该温度(800℃)下的平衡常数K=________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有_____(填字母)
A.升高温度 B.降低温度 C.增大压强D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率_______(填“升高”、“降低”、“不变”)。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L;c(CO2 )=c(H2)=0.13mol/L,则此时正、逆反应速率的大小:v正 _______ v逆 (填“>”、“<”或“=”)。
Ⅱ、还原法炼铅,包含反应PbO(s)+CO(g) Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
| 温度/℃ | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为_____(保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量_____ (填“增大”、“减小”或“不变”)。

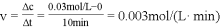
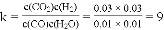

CH3CH2Br+H2O 小于 乙醇可与H2O分子间形成氢键,而溴乙烷不能 CH3CH2OH
CH2=CH2+H2O或2CH3CH2OH
CH3CH2OCH2CH3+H2O b 分液漏斗 ⑤①④③②
CH3CH2Br+H2O;(2)由于乙醇可与H2O分子间形成氢键,而溴乙烷不能,所以溴乙烷的水溶性小于乙醇的水溶性;(3)温度过高会产生乙烯或乙醚,即CH3CH2OH
CH2=CH2↑+H2O或2CH3CH2OH
CH3CH2OCH2CH3+H2O;(4)粗制的C2H5Br呈棕黄色,说明含有单质溴杂质,则,A.溴在溴乙烷中的溶解度比在水中大,加水难以除去溴乙烷中的溴,A错误;B.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,B正确;C.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,C错误;D.溴乙烷能够与氢氧化钠反应,D错误;答案选B;分液使用的主要仪器是分液漏斗;(5)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为⑤①④③②。

不能最终被氧化为-COOH;


