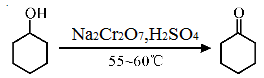-
环已酮是工业上的一种重 要有机合成原料和溶剂.实验室制备原理为: 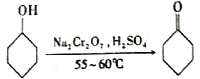 ,其反应的装置示意图如下(夹持装置加热装置略去):
,其反应的装置示意图如下(夹持装置加热装置略去):
已知:
| 物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.962 | 能溶于水 |
| 环已酮 | 155.6(95) | 0.948 | 微溶于水 |
(注:括号中的数据表示该有机物与水形成的具有固定组成的恒沸物的沸点)
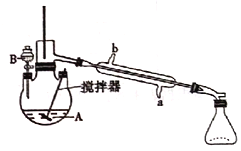
(1)制备产品。 通过仪器B____ ( 填仪器名称)将酸性Na2Cr2O7和H2SO4混合溶被加到盛有环已醇的三颈烧瓶A中,通过______( 填序号)方法加热到55-60℃进行反应。
a.酒精灯加热 b.油浴加热 c.水浴加热
(2)分离粗品。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分(主要含环已酮粗品和水的混合物),试解释无法分离环己酮和水的原因是____________。
(3)提纯环已酮。
①在收集到的粗品中加NaCl固体至饱和,静置,分液。加入NaCl固体的作用是________。
②加入无水MgSO4固体,除去有机物中________ (填物质名称)。
③过滤,蒸馏,收集151-156℃馏分,得到精品。
(4)下列关于实验的叙述中,错误的是________。
A.冷凝管的冷水应该从b进从a出
B.实验开始时,温度计水银球应插入反应液中,便于控制反应液的温度
C.装置B中也可加入Na2Cr2O7和稀盐酸混合溶液
D.反应过程中,需不断搅拌
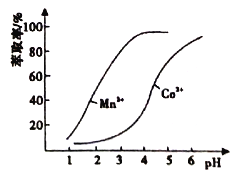
(5)利用环已酮做萃取剂可分离含Co2+、Mn2+的溶液,根据下图信息可判断,将pH范围控制在_______左右时可分离出Mn2+。
-
实验室制备环己酮的反应原理:
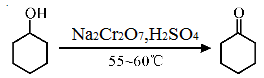
其反应的装置示意图如下(夹持装置、加热装置略去):

环己醇、环己酮、饱和食盐水和水的部分物理性质见下表(注:括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点)
| 物质 | 沸点(℃) | 密度(g·cm-3, 20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.962 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.948 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.330 | |
| 水 | 100.0 | 0.998 | |
(1)实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
① 仪器B的名称是 。
② 蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是 。
③ 蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151~ 156℃馏分,得到精品
b.过滤
c.在收集到的粗品中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水
① 上述操作的正确顺序是 (填序号)。
② 在上述操作c中,加入NaCl固体的作用是 。
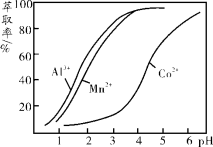
(3)环己酮是一种常用的萃取剂,以环己酮为成分之一的萃取液对金属离子的萃取率与pH的关系如上图。现有某钴矿石的盐酸浸出液, 浸出液含有的阳离子主要有H+、Co2+、Mn2+、Al3+,除去Al3+ 后,再利用萃取法分离出MnCl2以得到较为纯净的CoCl2溶液,pH范围应控制在 。
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(4)在实验中原料用量:20mL环己醇、酸性Na2Cr2O7溶液10mL,最终称得产品质量为14.7g,则所得环己酮的产率为 (百分数精确到0.1)。
(5)实验产生的含铬废液易污染环境,可将Cr2O72-转化为Cr3+,再转化为Cr(OH)3沉淀除去,为使Cr3+浓度小于1×10-5mol/L,应调节溶液的pH=___________。(已知该条件下Cr(OH)3的Ksp是6.4×10-31, lg2=0.3 lg5=0.7)
-
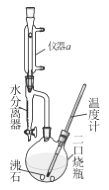
正丁醚可作许多有机物的溶剂及萃取剂 ,常用于电子级清洗剂及用于有机合成 。实验室用正丁醇与浓H2SO4反应制取,实验装置如右图,加热与夹持装置略去。反应原理与有关数据:
反应原理: 2C4H9OH  C4H9OC4H9+H2O
C4H9OC4H9+H2O
副反应:C4H9OH C2H5CH=CH2+H2O
C2H5CH=CH2+H2O
| 物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 水 | 50%硫酸 | 其它 |
| 正丁醇 | 74 | -89.8 | 117.7 | 微溶 | 易溶 | 二者互溶 |
| 正丁醚 | 130 | -98 | 142.4 | 不溶 | 微溶 |
实验步骤如下:
①在二口烧瓶中加入0.34mol正丁醇和4.5mL浓H2SO4,再加两小粒沸石,摇匀。
②加热搅拌,温度上升至100~ll0℃开始反应。随着反应的进行,反应中产生的水经冷凝后收集在水分离器的下层,上层有机物至水分离器支管时,即可返回烧瓶。加热至反应完成。
③将反应液冷却,依次用水、50%硫酸洗涤、水洗涤,再用无水氯化钙干燥,过滤,蒸馏,得正丁醚的质量为Wg。
请回答:
(1)制备正丁醚的反应类型是____________,仪器a的名称是_________。
(2)步骤①中药品的添加顺序是,先加______(填“正丁醇”或“浓H2SO4”),沸石的作用是___________________。
(3)步骤②中为减少副反应,加热温度应不超过_________℃为宜。使用水分离器不断分离出水的目的是________。如何判断反应已经完成?当_____时,表明反应完成,即可停止实验。
(4)步骤③中用50%硫酸洗涤的目的是为了除去______________。本实验中,正丁醚的产率为_____(列出含W的表达式即可)。
-
锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点114.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2 SnI4制备SnI4,装置如图(夹持、加热装置略去)。下列说法正确的是( )
SnI4制备SnI4,装置如图(夹持、加热装置略去)。下列说法正确的是( )
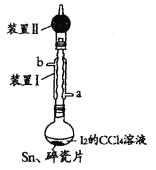
A.SnI4不溶于CCl4
B.装置Ⅰ中b为冷凝水进水口
C.加入碎瓷片的目的是防止暴沸
D.装置Ⅱ的主要作用是吸收挥发的I2
-
氮的化合物在工业生产中有广泛的用途
Ⅰ 实验室可用如下装置
实验室可用如下装置 略去部分夹持仪器
略去部分夹持仪器 制备亚硝酸钠。
制备亚硝酸钠。
已知:① ;
;
②酸性条件下,NO和 都能与
都能与 反应生成
反应生成 和
和 ;
; 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间 ,目的是_______________________。
,目的是_______________________。
(2)装置A中发生反应的化学方程式为_______。酸性 溶液的作用是_______。
溶液的作用是_______。
(3)仪器C的名称为______________,其中盛放的药品为 ____________ 填名称
填名称 。
。
Ⅱ 氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置。
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置。
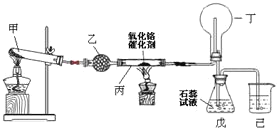
(1)已知甲装置试管中的固体是碳酸铵 晶体。为了实现探究目的,乙装置中的固体是___________。乙装置的作用是__________________。
晶体。为了实现探究目的,乙装置中的固体是___________。乙装置的作用是__________________。
(2)写出受热时丙装置发生反应的化学方程式为________________。
(3)当戊中观察到____________________________现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因:______________________。如何改进装置?_______。
(4)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是____。
-
氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)。
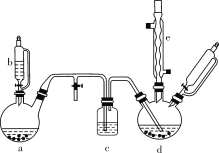
请回答下列问题:
(1)仪器b的名称是___。仪器a中盛有KMnO4晶体,仪器b盛有浓盐酸。打开仪器b的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是____,用离子方程式表示产生该现象的原因:_____
(2)仪器d内盛有苯、FeCl3粉末固体,仪器a中生成的气体经过仪器c进入仪器d中。仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是_____加热,其优点是________________。
(3)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3、HCl及部分Cl2,然后通过碱洗除去Cl2。碱洗后通过分液得到含氯苯的有机混合物,混合物成分及沸点如下表所示:
| 有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
| 沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机混合物中提取氯苯时,采用蒸馏的方法,收集____℃左右的馏分。
-
氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)。
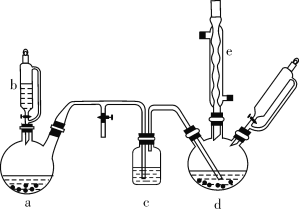
请回答下列问题:
(1)仪器b的名称是____。仪器a中盛有KMnO4晶体,仪器b盛有浓盐酸。打开仪器b的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是___,用离子方程式表示产生该现象的原因: __。
(2)仪器d内盛有苯、FeCl3粉末固体,仪器a中生成的气体经过仪器c进入仪器d中。仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是__。
(3)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3、HCl及部分Cl2,然后通过碱洗除去Cl2。碱洗后通过分液得到含氯苯的有机混合物,混合物成分及沸点如下表所示:
| 有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
| 沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机混合物中提取氯苯时,采用蒸馏的方法,收集____℃左右的馏分。
(4)实际工业生产中,苯的流失如下表所示:
| 流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
| 苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13 t苯,则制得氯苯____t(保留一位小数)。
-
氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)。
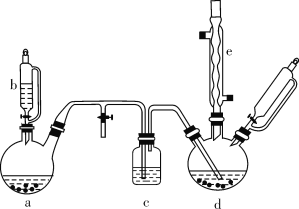
请回答下列问题:
(1)仪器b的名称是____。仪器a中盛有KMnO4晶体,仪器b盛有浓盐酸。打开仪器b的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是___,用离子方程式表示产生该现象的原因: __。
(2)仪器d内盛有苯、FeCl3粉末固体,仪器a中生成的气体经过仪器c进入仪器d中。仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是__。
(3)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3、HCl及部分Cl2,然后通过碱洗除去Cl2。碱洗后通过分液得到含氯苯的有机混合物,混合物成分及沸点如下表所示:
| 有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
| 沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机混合物中提取氯苯时,采用蒸馏的方法,收集____℃左右的馏分。
(4)实际工业生产中,苯的流失如下表所示:
| 流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
| 苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13 t苯,则制得氯苯____t(保留一位小数)。
-
氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)
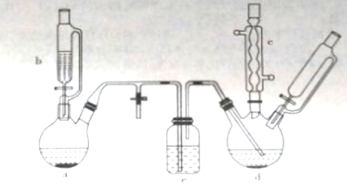
请回答下列问题:
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸。打开仪器b中的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是__________,用离子方程式表示产生该现象的原因:_______________。
(2)仪器b外侧玻璃导管的作用是_____________。
(3)仪器d内盛有苯,FeCl3粉末固体,仪器a中生成的气体经过仪器e进入到仪器d中。
①仪器e的名称是_________,其盛装的试剂名称是_____________。
②仪器d中的反应进行过程中,保持温度在40~60℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是____________。
(4)仪器c的作用是______________。
(5)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3,HCl及部分Cl2,然后通过碱洗除去Cl2;碱洗后通过分液得到含氯苯的有机物混合物,混合物成分及沸点如下表:
| 有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
| 沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机物混合物中提取氯苯时,采用蒸馏的方法,收集_________℃作用的馏分。
(6)实际工业生产中,苯的流失如下表:
| 流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
| 苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13t苯,则制得氯苯________t(保留一位小数)。
-
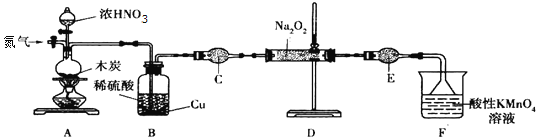
亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室以木炭、浓硝酸、Na2O2为主要原料按照如图所示装置制各亚硝酸钠(加热装置及部分夹持装置已略去),反应原理为:2NO+Na2O2=2NaNO2。
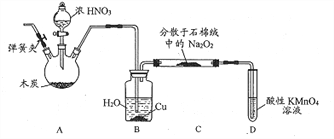
回答下列问题:
(1)A装置中反应的化学方程式为__________________。
(2)B装置中铜的作用是__________________。
(3)充分反应后,C中生成的固体除NaN02外,还可能有杂质生成,应在B、C之间加一个装置,该装置所盛放试剂的名称是_________________。
(4)检查装置气密性并装入药品后,以下实验操作步骤正确的顺序为____________________填标号)。
a.打开弹簧夹,向装置中通入N2 b.点燃酒精灯
c.向三颈烧瓶中滴加浓硝酸 d.熄灭酒精灯
e.关闭分液漏斗旋塞 f.停止通入N2
(5)D装置用于尾气处理,写出D中反应的离子方程式:___________________。
(6)利用改进后的装置,将7.8gNa2O2完全转化成NaNO2,理论上至少需要木炭____g。
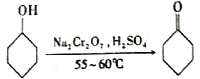 ,其反应的装置示意图如下(夹持装置加热装置略去):
,其反应的装置示意图如下(夹持装置加热装置略去):