-
下表为元素周期表中前四周期的部分元素,表中所列的字母分别代表一种化学元素,根据要求回答下列各小题:

(1)①元素非金属性强弱比较有很多方法,其中f和j的非金属性强弱的研究方案中不可行的是_________(填序号)
a.比较两种单质的颜色 b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较电负性 e.比较最高价氧化物对应水合物的酸性
②根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,则属于s区的元素有_______种,属于d区的元素有_______种;元素n属于________区。
③在c、d、e三种元素中,电负性由小到大的顺序是______________,第一电离能由大到小的顺序是____________(用元素符号回答)。
(2)①写出 n2+的核外电子排布式:______________________。
②写出k元素基态原子的价电子排布式:_____________。
③写出 L元素基态原子的外围电子排布式:_____________。
④写出m元素基态原子价电子的轨道表示式:________________________,该元素在元素周期表中的位置为:__________________________。
⑤j简单阴离子的结构示意图为____________。
(3)①元素i的氢化物分子属于____________(填“极性”或“非极性”)分子,其分子的空间构型为____________,该氢化物分子中i原子轨道的杂化类型是__________; 由i与e形成的ie42-离子,其空间构型为__________(用文字描述)。
②已知cd- 与 d2 结构相似,1 mol cd- 中 键数目为___________,由d形成的离子d3-与CO2互为等电子体,则d3-的分子构型为___________。
键数目为___________,由d形成的离子d3-与CO2互为等电子体,则d3-的分子构型为___________。
③f2通入稀NaOH溶液中可生成Of2,Of2分子构型为___________,其中氧原子的杂化方式为_______;
④化合物j2e的立体构型为_________,中心原子的价层电子对数为__________。
-
下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.请你根据表中所给元素,回答下列问题:

(1)在短周期的所有元素中________的原子半径与________的原子半径之比最小(不包括稀有气体)(填元素符号).
(2)金属性最强的元素与氧气反应生成化合物的化学式是________(填两种即可),j和k氢化物比较,稳定性强的是________(填写氢化物化学式).
(3)海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,其单质做消毒杀菌剂的原因是________(用化学方程式表示).
(4)常温下某液态化合物只含上述元素中的两种,分子中原子个数比1:1,请你仅用一个化学方程式表示该液态化合物既有氧化性又有还原性________.
-
下表是现行中学化学教科书中元素周期表的一部分,表中的每个字母代表一种短周期元素,请根据要求回答问题.

(1)写出B的最高价氧化物的电子式______;
(2)画出H的原子结构示意图______;
(3)A和G、A和H形成的气态化合物,较稳定的是______(填写化学式);
(4)D、E的离子半径相比较,较大的是______(填离子符号);
(5)写出F的单质与E的高价氧化物的水化物反应的方程式______;
(6)有甲、乙两种化合物均由A、D、E、G四种元素形成,甲、乙的溶液相反应有气体生成,写出该反应的离子方程式______.
(7)由A、B、C、D四种元素的各一个原子形成的共价分子,每个原子的电子层结构都饱和,写出这种分子可能的结构式______、______.
-
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
| a | | |
| b | | | | c | d | e | f | |
| g | h | i | j | | k | l | m |
| n | | | | | | | o | | | | | | | | | | |
试回答下列问题:
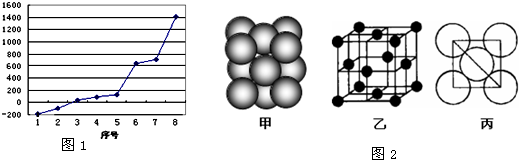
(1)请写出字母O代表的元素符号______,该元素在周期表中的位置______.
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表______(填元素符号);其中电负性最大的是______(填如图1中的序号).
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是______(填化学式),试从结构角度加以解释:______.
(4)k与l形成的化合物kl2的电子式是______,它在常温下呈液态,形成晶体时,属于______晶体.
(5)i单质晶体中原子的堆积方式如图2(甲)所示,其晶胞特征如图2(乙)所示,原子之间相互位置关系的平面图如图2(丙)所示.若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
一个晶胞中i原子的数目为______,该晶体的密度_______
-
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.

试回答下列问题:(答案中涉及字母均用具体元素符号作答)
(1)I的元素符号为___, 在周期表中位于______区。
(2)写出基态时J元素基态原子原子的价电子排布式_______________,J在周期表中的位置是______。
(3)ABGH的原子半径由大到小顺序是________________;ABCD的第一电离能由大到小顺序是_______;ABCD的电负性由大到小顺序是_____________。
-
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:
试回答下列问题:(答案中涉及字母均用具体元素符号作答)
(1)I的元素符号为___, 在周期表中位于______区。
(2)写出A原子的核外电子排布的电子排布图 _____________________ ,写出基态时J元素基态原子原子的价电子排布式_______________,J在周期表中的位置是__________;
(3)ABGH的原子半径大小顺序是________________;ABCD的第一电离能大小顺序是_______;ABCD的电负性大小顺序是____________。
-
元素周期表是学习化学的重要工具,下图所示为元素周期表中的一部分。表中所列的字母分别代表对应的化学元素。

(1)上述元素中,金属性最强的元素在周期表中的位置是______;最高价氧化物对应水化物中酸性最强的元素是___________(填元素符号)。常温下,其单质在浓硝酸中会发生钝化的元素是_______(填元素符号)。
(2)元素g的简单离子结构示意图为______,元素d的一种氢化物中两种原子的个数比为1: 1,则该物质的电子式为___________
(3)k元素可能的性质或应用有________。
A.是一种活泼的金属元素 B.其简单氢化物的热稳定性比h强
C.其单质可作为半导体材料 D.最高正化合价为+4
(4)下列说法正确的是________
A.简单离子半径的大小顺序: r(d>r(e>r(g)>r(f)
B.元素非金属性由强到弱的顺序:e>d>c
C.f、g、i最高价氧化物对应的水化物两两之间能发生反应
D.化合物f2d2中,阴、阳离子个数之比为1:1
(5)元素a与元素g有相似的化学性质。请写出元素a的氢氧化物与NaOH溶液反应的化学方程式:_____________。
-
(7分)元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素。请用所给元素回答下列问题。
(1)某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为________。
 (2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)________。
(2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)________。
(3)M、D两种元素形成的化合物含有的化学键类型是 ________ ,其分子是(填“极性”或“非极性”)________分子;
A分别与D、E、R形成的分子中,分子间存在氢键的是(填分子式)________。
A与D形成分子的空间结构可能是(填序号)________。(2分)
-
元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母a、b、c、d、e、f、g、m、n、o、r分别代表某一种元素。请回答下列问题。
(1)g元素的原子序数为 ;上述所给11种元素中非金属元素共有 种。
(2)m元素在元素周期表中的位置 ;e、n二元素形成的稳定化合物的化学式为 。
(3)o元素离子的电子式为 ;化合物ba3的结构式为 。
(4)用电子式表示化合物d2n的形成过程 ;
(5)d的最高价氧化物的水化物与e的最高价氧化物反应的离子方程式 。
(6)单质r与b的最高价氧化物的水化物的稀溶液反应的离子方程式 。
-
下表是元素周期表的一部分,所列的字母分别代表一种元素。
试回答下列问题:(填写时用对应元素符号或物质的化学式)
(1)f、g、l的简单离子的半径由小到大的顺序是 。
(2)原子Zn位于周期表中的 区,元素o在周期表中的位置是 ,元素o的二价阳离子的核外电子排布式是 。
(3)根据下表所示原子逐级电离能的数据分析并回答
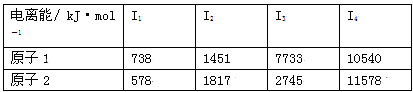
原子2对应周期表的元素是 ,原子1的第一电离能高于原子2的原因是 。
(4)周期表中所示各原子对应最高价氧化物的水化物碱性最强的是 (填水化物的化学式,下同),酸性最强的是 。写出碱性最强的水化物与Al(OH)3反应的离子方程式 。

键数目为___________,由d形成的离子d3-与CO2互为等电子体,则d3-的分子构型为___________。








