-
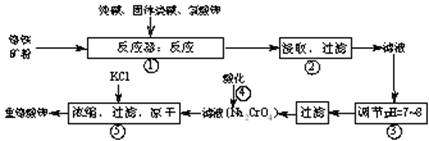
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料来生产。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
12Na2CrO4+3Fe2O3 +7KCl+12H2O,
试回答下列问题:
⑴ 反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:。
⑵ NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:。
⑶ 作③的目的是什么,用简要的文字说明:。
⑷操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:。
⑸称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
② 断达到滴定终点的现象是;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)。
-
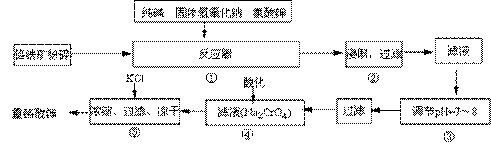
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,请回答下列问题:
(1)以上工艺流程所涉及元素中属于过渡元素的有________,铁在周期表中的位置是第______周期______族。
(2)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:_________________。
(3)NaFeO2能发生强烈水解,在步骤②中生成沉淀而除去,写出该反应的化学方程式:_________________。
(4)流程④中酸化所用的酸和流程⑤中所用的某种盐最合适的是____________(填字母)。
A.盐酸和氯化钾 B.硫酸和氯化钾 C.硫酸和硫酸锌 D.次氯酸和次氯酸钾
酸化时,CrO 转化为Cr2O
转化为Cr2O ,写出平衡转化的离子方程式:________________。
,写出平衡转化的离子方程式:________________。
(5)水溶液中的H+是以H3O+的形式存在,H3O+的电子式为_____________。
(6)简要叙述操作③的目的:________________。
-
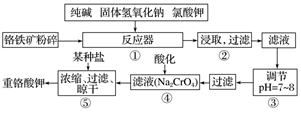
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO•Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
试回答下列问题
(1)指出24Cr在周期表中的位置是______,
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:______.
(3)操作③调节pH=7~8的原因是______.(用简要的文字和离子方程式说明)
下表是铬酸(H2CrO4)溶液中离子的组成与pH的关系:
| pH | C(CrO42-)mol/L | C(HCrO4-)mol/L | C(Cr2O72-)mol/L | C(H2CrO4)mol/L |
| 4 | 0.0003 | 0.104 | 0.448 | |
| 5 | 0.0033 | 0.103 | 0.447 | |
| 6 | 0.0319 | 0.0999 | 0.437 | |
| 7 | 0.2745 | 0.086 | 0.3195 | |
| 8 | 0.902 | 0.0282 | 0.0347 | |
| 9 | 0.996 | 0.0031 | 0.0004 | |
(4)操作④酸化的目的是______.
(5)在铬酸(H2CrO4)溶液中,电离出CrO42-的电离平衡常数为K2,电离出Cr2O72-的电离平衡常数为K3,则K2______K3(填>、﹦、<)
(6)上表中铬酸的物质的量浓度为______.(精确到小数点后2位)
-
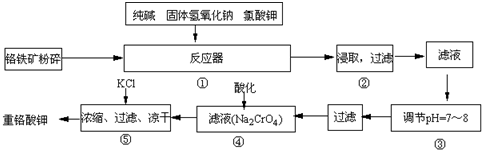
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO•Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
试回答下列问题
(1)指出24Cr在周期表中的位置是______,
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:______.
(3)操作③调节pH=7~8的原因是______.(用简要的文字和离子方程式说明)
下表是铬酸(H2CrO4)溶液中离子的组成与pH的关系:
| pH | C(CrO42-)mol/L | C(HCrO4-)mol/L | C(Cr2O72-)mol/L | C(H2CrO4)mol/L |
| 4 | 0.0003 | 0.104 | 0.448 | |
| 5 | 0.0033 | 0.103 | 0.447 | |
| 6 | 0.0319 | 0.0999 | 0.437 | |
| 7 | 0.2745 | 0.086 | 0.3195 | |
| 8 | 0.902 | 0.0282 | 0.0347 | |
| 9 | 0.996 | 0.0031 | 0.0004 | |
(4)操作④酸化的目的是______.
(5)在铬酸(H2CrO4)溶液中,电离出CrO42-的电离平衡常数为K2,电离出Cr2O72-的电离平衡常数为K3,则K2______K3(填>、﹦、<)
(6)上表中铬酸的物质的量浓度为______.(精确到小数点后2位)
-
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产。实验室模拟工业生产如下图:
 涉及的主要反应为:
涉及的主要反应为:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4 +3Fe2O3+7KCl+12H2O

 在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐。氧化铝与碳酸钠发生的反应为Al2O3 + Na2CO3 2NaAlO2 +CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O NaAl(OH)4
在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐。氧化铝与碳酸钠发生的反应为Al2O3 + Na2CO3 2NaAlO2 +CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O NaAl(OH)4
 Al(OH)3+NaOH。
Al(OH)3+NaOH。
(1)写出二氧化硅与碳酸钠反应的化学方程式。
(2)NaFeO2能强烈水解,在操作②中生成沉淀而除去,试写出该反应的化学方程式:
________。
(3)操作③调节后溶液的pH比原来降低,调节的目的是(用简要的文字和必要的离子方程式说明)
________
________。
(4)称取重铬酸钾(K2Cr2O7式量为294)试样m g配成VmL溶液,取出V1 mL于锥形瓶中,加入适量的稀H2SO4和足量碘化钾,放于暗处5min,然后加入100mL水,同时加入3mL淀粉溶液作指示剂,用c mol•L-1Na2S2O3标准溶液滴定(相关反应为: Cr2O72-+6I-+14H+= 2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- )。则:
①取V1 mL待测液应选用的仪器为________(写仪器名称)。
②判断达到滴定终点的依据是________。
③设整个过程中其它杂质不参与反应。若实验中共用去Na2S2O3标准溶液V2mL,则计算所得产品中重铬酸钾纯度的代数式为 ________
(不必化简)。
-
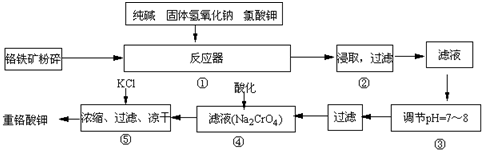
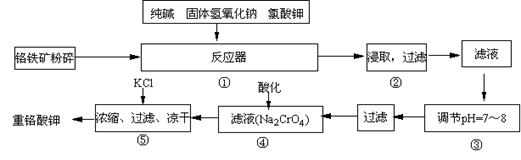
(15分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
12Na2CrO4+3Fe2O3 +7KCl+12H2O,
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
________。
(2)操作③的目的是什么,用简要的文字说明:________
________。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
。
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定。
(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)________ %(保留小数点后两位)。
-
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿为原料生产.实验室模拟工业生产如下图:
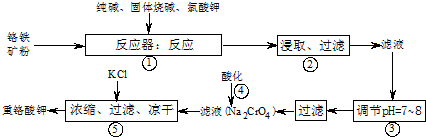
涉及的主要反应为:6FeO•Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐.氧化铝与碳酸钠发生的反应为Al2O3+Na2CO3 2NaAlO2+CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O⇌NaAl(OH)4⇌Al(OH)3+NaOH.
2NaAlO2+CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O⇌NaAl(OH)4⇌Al(OH)3+NaOH.
(1)写出二氧化硅与碳酸钠反应的化学方程式______ Na2SiO3+CO2
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO • Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
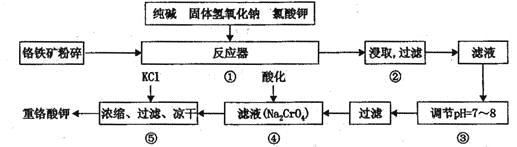
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:________________。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:_______________。
(3)简要叙述操作③的目的:________________________。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:___________。
(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度________________ (设整个过程中其它杂质不参与反应)。
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO • Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3  12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
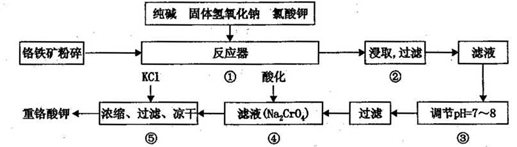
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:________________。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式: _______________。
(3)简要叙述操作③的目的:________________________。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:___________。
(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加 入10 mL 2mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度________________ (设整个过程中其它杂质不参与反应)。
-
(14分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
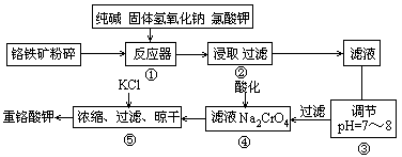
(1)碱浸前将铬铁矿粉碎作用 。
(2)反应器①中除发生题中所给反应外,请写出其他两个化学方程式(要求两个反应中反应物均相同) ; 。③中调节PH=7-8所得滤渣为 、 。
(3)从平衡角度分析④中酸化的原理 ;
(4)用简要的文字说明操作⑤加入KCl能得到K2Cr2O7晶体的原因是 。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25.00mL于碘量瓶中,向其中加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32—=2I—+S4O62—)
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应) (保留2位有效数字)。
涉及的主要反应为:
在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐。氧化铝与碳酸钠发生的反应为Al2O3 + Na2CO3 2NaAlO2 +CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O NaAl(OH)4
Al(OH)3+NaOH。