-
MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示:
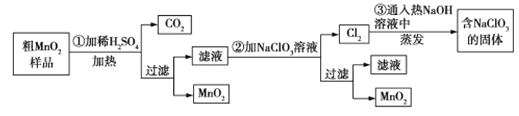
(1)第①步反应中的硫酸能否用浓盐酸代替?____(填“能”或“否”),理由是______________。
(2)第②步操作中,氧化性强弱顺序:ClO3—___MnO2(填“>”或“<”),写出操作②中发反应的离子方程式:____;当反应中转移2mol电子时,生成的氧化产物的物质的量为___mol。
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。制取K2MnO4的化学反应方程式为______,工业上不断搅拌的目的是______。
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI MnCl2+I2+2KCl+2H2O
MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3 2NaI+Na2S4O6
2NaI+Na2S4O6
取较为纯净的二氧化锰样品a g加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗VmLNa2S2O3溶液,则该样品中MnO2含量为______%(杂质不参与反应)。
-
高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:
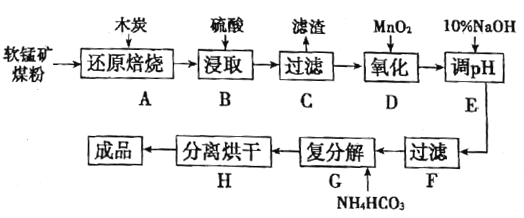
已知:还原焙烧主反应为2MnO2+C 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.1 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 10.1 |
根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________中加热;步骤C中的滤渣为__________。
(2)步骤D中氧化剂与还原剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为__________,其目的是__________。
(4)步骤G,温度控制在35℃以下的原因是__________,若Mn2+恰好沉淀完全时测得溶液中 的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是__________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中 完全转化为
完全转化为 );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应 +
+ =N2↑+2H2O以除去
=N2↑+2H2O以除去 ;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2
;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2 ;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程为__________。
②试样中锰元素的质量分数为__________。
-
碳酸锰(MnCO3)是一种高性能磁性材料。以软锰矿粉(主要含MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制取MnCO3的流程如下:
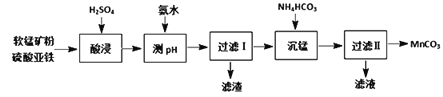
已知:“沉锰”反应为:Mn2+ + 2HCO == MnCO3↓+ H2O + CO2↑
== MnCO3↓+ H2O + CO2↑
(1)“酸浸”时发生的主要反应为:2Fe2+ + MnO2+ 4H+ == 2Fe3+ + Mn2+ + 2H2O。除此以外,还发生的反应离子方程式为________。(任写一个)
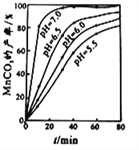
(2)“沉锰”工序中,实验测得MnCO3的产率与溶液pH、反应时间t的关系如图所示。反应要控制pH在7左右的理由是_________。(答两点)
(3)“过滤Ⅱ”所得滤液中溶质的主要成分是_________。
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.800g软锰矿样品,加入4.020 g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,过量的Na2C2O4用0.2000 mol/L高锰酸钾溶液进行滴定,当滴入30.00mL溶液时恰好完全反应。已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:MnO2 + C2O + 4H+
+ 4H+  Mn2+ + 2CO2↑+ 2H2O,MnO4-+ C2O
Mn2+ + 2CO2↑+ 2H2O,MnO4-+ C2O + H+ — Mn2+ + CO2↑+ H2O (未配平)。求该软锰矿中二氧化锰的质量分数_________(写出计算过程)。
+ H+ — Mn2+ + CO2↑+ H2O (未配平)。求该软锰矿中二氧化锰的质量分数_________(写出计算过程)。
-
MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:

回答下列问题:
(1)操作Ⅰ为:___________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为(_______)
| A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为___________,滤渣Ⅱ为___________。
(5)沉锰的化学方程式为:______________________。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________。
-
MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下:

已知:MnCO3难溶于水和乙醇,受热易分解。
⑴ 实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、 。
⑵ ①检验水洗是否合格的方法是 。
②水洗结束后,用乙醇洗涤的目的是 。
⑶ MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
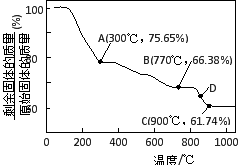
-
Ⅰ.高锰酸钾是锰的重要化合物和常用氧化剂,在实验室和医疗上有非常广泛的应用。如图1是工业上用软锰矿(主要含MnO2)制备高锰酸钾晶体的一种工艺流程:
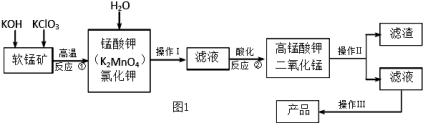
(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是(用化学方程式表示)。写出反应①的离子方程式;
(2)反应②的产物中,氧化产物与还原产物的物质的量的比是
(3)反应②中“酸化”时应选择下列酸中的(填序号)
a.稀盐酸b.稀硫酸c.亚硫酸
(4)操作Ⅱ的名称是,实验室进行该操作需用到的玻璃仪器有
Ⅱ.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质
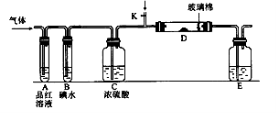
(5)若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?(填“相同”或“不相同”)。
(6)若装置B中装有5.0mL1.0mol/L的碘水,当通入足量C l2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为;
l2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为;
(7)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3。当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取少量上层清加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式。
-
回收的废旧锌锰干电池经过处理后可得到锰粉(含MnO2、Mn(OH)2、Fe和炭粉等),由锰粉为主要原料制备高性能磁性材料碳酸锰(MnCO3)的工艺流程如下:
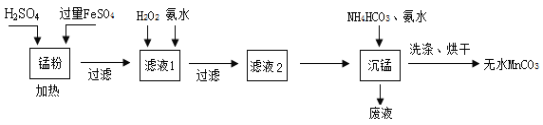
已知:①2H2SO4 + MnO2 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O
②部分氢氧化物的Ksp(近似值)如下表(25 ℃)
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 10-13 | 10-17 | 10-38 |
根据上图流程及有关数据回答下列问题。
(1)锰粉酸溶时,过量FeSO4所起的作用为______________________。
(2)往滤液1中先加入H2O2的目的是氧化Fe2+,该反应的离子方程式为________________,后加入氨水的目的是调节pH除去杂质离子,使滤液中的杂质离子沉淀完全(残留在溶液中的离子浓度≤ l0-5 mol·L-1),常温下测得溶液中c(Mn2+)=0.1 mol·L-1,则需调节溶液的pH范围为_______________。
(3)沉锰工序中,加入氨水的目的是(从化学平衡移动的角度解释)___________,沉锰工序中判断沉淀已经洗涤干净的实验操作是________________________________。
(4)沉锰后废液中的主要成份为_____________________________。
-
软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
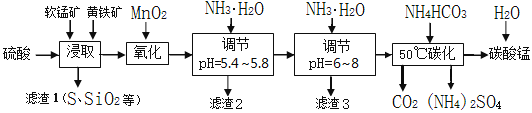
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
| 开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
| 完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。
-
MnO2是一种重要的化工原料,可用于合成工业的催化剂和氧化剂。采用软锰矿(主要成分为MnO2)可制备高纯MnO2,其流程如下:

下列叙述错误的是
A. “含Mn2+、A13+的溶液”中还含Fe3+
B. 加入“氨水”同时搅拌,搅拌的目的是提高反应速率
C. “滤渣”可完全溶解在NaOH溶液中
D. 电解含Mn2+的溶液,MnO2为阳极产物
-
高锰酸钾是锰的重要化合物和常用氧化剂,在实验室和医疗上有非常广泛的应用。以下是工业上用软锰矿(主要含MnO2)制备高锰酸钾晶体的一种工艺流程:
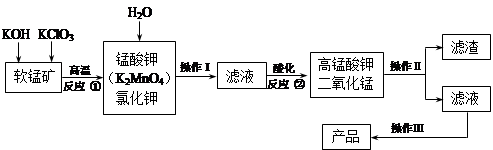
(1)操作Ⅱ的名称是_______,实验室进行该操作须用到的玻璃仪器有 ;
(2)反应②的产物中,氧化产物与还原产物的物质的 量之比是______;
(3)反应②中“酸化”时不能选择下列酸中的______(填字母序号)
a.稀盐酸 b.稀硫酸 c.稀醋酸
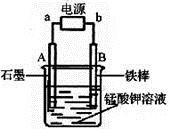
(4)电解锰酸钾溶液也可以制备高锰酸钾,其阴极反应式为:2H2O + 2e-= 2OH-+ H2↑,如图,b为电源的_______极,电解池的阳极反应式是_______;若电解过程中收集到2.24 L H2(标准状况),则得到高锰酸钾______g。(提示:阴离子放电顺序MnO42->OH-)

MnCl2+I2+2KCl+2H2O
2NaI+Na2S4O6











