-
甲烷自热氧化重整是工业上获得氢气的重要方法,其反应为:
2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=akJ/mol。
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=bkJ/mol
②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2
③CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=ckJ/mol。
则△H2=___________kJ/mol(用含a、b、c的代数式表示)。
(2)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)=CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。图1为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。CO的平衡转化率在不同压强下随温度的变化如图2所示。
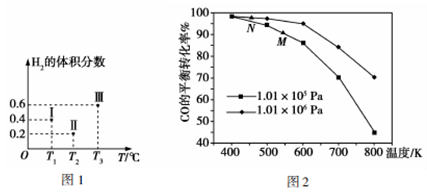
①0~5min时间内容器II中用CH3OH表示的反应速率为___________。
②三个容器中一定达到平衡状态的是容器________。
③当三个容器中的反应均达到平衡状态时,CO的转化率最低的是容器______。
④平衡常数最大的是容器__________。
⑤工业实际合成CH3OH生产中,常用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由:______________。
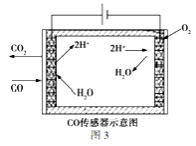
(3)合成甲醇尾气中CO的浓度常用电化学气敏传感器进行测量,其中CO传感器可用图3简单表示,则阳极发生的电极反应为_______________。
-
对甲烷和CO2的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合CO2重整反应有:
反应(i):2CH4(g)+O2(g) 2CO(g)+4H2(g) △H=-71.4kJ•mol-1
2CO(g)+4H2(g) △H=-71.4kJ•mol-1
反应(ii):CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+247.0kJ•mol-1
2CO(g)+2H2(g) △H=+247.0kJ•mol-1
(1)写出表示CO燃烧热的热化学方程式:_____。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g) 2CO(g)+2H2(g)(不发生其它反应),CO2的平衡转化率如下表所示:
2CO(g)+2H2(g)(不发生其它反应),CO2的平衡转化率如下表所示:
| 起始物质的量(n)/mol | CO2的平衡转化率 |
| CH4 | CO2 | CO | H2 |
| Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
| Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列能说明反应达到平衡状态是_____。
A.v正(CH4)=2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②若容器Ⅰ内反应从开始到平衡所用的时间为tmin,则tmin内该反应的平均反应速率为:v(H2)=____(用含t的表达式表示)。
③达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:2n(CO)Ⅰ___n(CO)Ⅱ(填“>”、“=”或“<”)。
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生上述反应(i):2CH4(g)+O2(g) 2CO(g)+4H2(g),测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
2CO(g)+4H2(g),测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
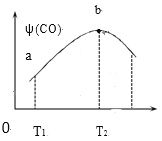
①T2℃时,CO体积分数最大的原因是____。
②若T2℃时,容器内起始压强为P0,平衡时CO的体积分数为20%,则反应的平衡常数KP=___(用平衡分压强代替平衡浓度计算,分压=总压×物质的量分数)。
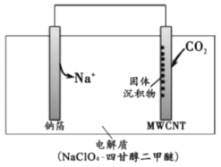
(4)2016年我国科研人员根据反应Na+CO2→Na2CO3+C(未配平)研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。其放电时的工作原理如图所示,已知吸收的全部CO2中,有 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:___。
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:___。
-
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整.向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应过程 | 化学方程式 | 焓变△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H=______kJ/mol.
(2)在初始阶段,甲烷蒸汽重整的反应速率______甲烷氧化的反应速率(填大于、小于或等于).
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)的KP=______;随着温度的升高,该平衡常数______(填“增大”、“减小”或“不变”).
(4)从能量角度分析,甲烷自热重整方法的先进之处在于______.
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如图1、图2:
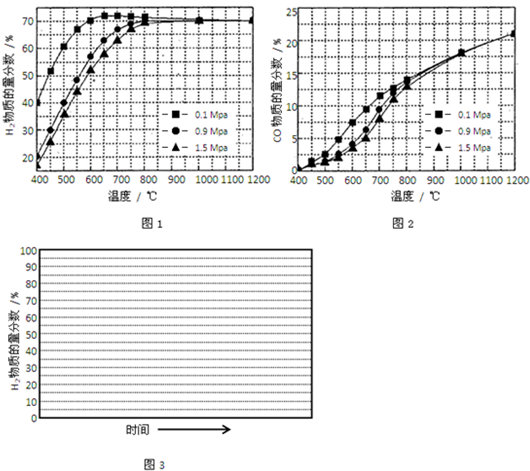
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是______.
A.600℃,0.9MpaB.700℃,0.9MPaC.800℃,1.5MpaD.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图(如图3):
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是______.
-
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应 过程 | 化学方程式 | 焓变△H (kJ/mol) | 正反应活化能Ea (kJ/mol) |
| 甲烷 氧化[ | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 |
| 蒸汽 重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g) CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
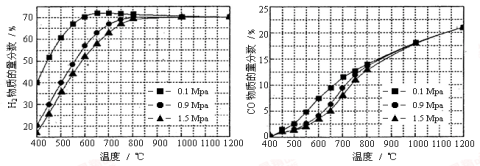
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9Mpa C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
-
[15分]甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应过程 | 化学方程式 | 焓变△H (kJ/mol) | 活化能Ea (kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g) CO2(g)+2H2O(g) CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g) CO2(g)+2H2(g) CO2(g)+2H2(g) | -322.0 | 172.5 |
| 蒸汽重整 | CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g) CO2(g)+4H2(g) CO2(g)+4H2(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g) CO2(g)+H2(g)的△H= kJ/mol。
CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g) CO(g)+3H2(g)的KP= ;
CO(g)+3H2(g)的KP= ;
随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
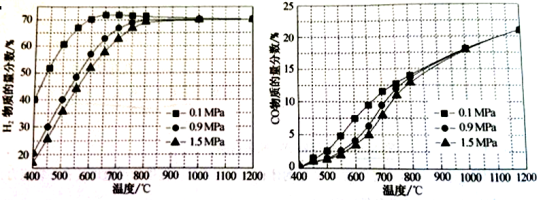
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9MPa C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始即时)
的变化趋势示意图:
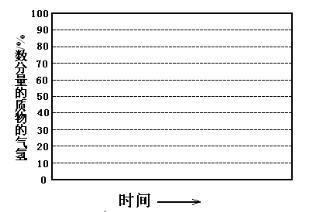
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
-
(13分)
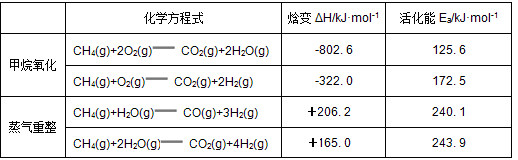
甲烷自热重整是先进的制氢方法, 包含甲烷氧化和蒸气重整。向反应系统同时通入甲烷、氧气和水蒸气, 发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)  CO2(g)+H2(g)的ΔH= kJ·mol-1。
CO2(g)+H2(g)的ΔH= kJ·mol-1。
(2)在初始阶段, 甲烷蒸气重整的反应速率 甲烷氧化的反应速率(填“大于”、“小于”或“等于”)。
(3)对于气相反应, 用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp), 则反应CH4(g)+H2O(g) CO(g)+3H2(g)的Kp= 随着温度的升高, 该平衡常数 (填“增大”、“减小”或“不变”)。
CO(g)+3H2(g)的Kp= 随着温度的升高, 该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析, 甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下, 温度、压强对H2和CO物质的量分数的影响如下图:
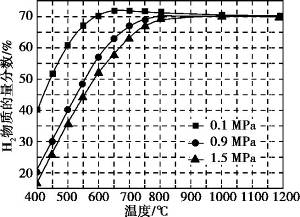
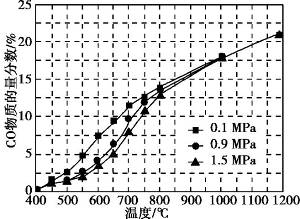
①若要达到H2物质的量分数>65%、CO物质的量分数<10%, 以下条件中最合适的是 。
A.600 ℃, 0.9 MPa B.700 ℃, 0.9 Mpa
C.800 ℃, 1.5 MPa D.1 000 ℃, 1.5 MPa
②画出600 ℃, 0.1 MPa条件下, 系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
(6)如果进料中氧气量过大, 最终导致H2物质的量分数降低, 原因是 。
-
天然气水蒸汽重整法是工业上生产氢气的重要方法,反应在 400℃以上进行。l 00kPa 时,在反应容器中通入甲烷与为水蒸汽体积比为1 : 5的混合气体,发生下表反应。
| 反应方程式 | 焓变△H(kJ/mol) | 600℃时的平衡常数 |
| ①CH4(g)+ H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | a | 0.6 |
| ②CH4(g)+ 2H2O(g)  CO2(g)+4H2 (g) CO2(g)+4H2 (g) | +165.0 | b |
| ③CO(g)+ H2O(g)  CO2(g)+H2 (g) CO2(g)+H2 (g) | -41.2 | 2.2 |
请回答下列下列问题:
(1)上表中数据 a=__________; b= ___________ 。
(2)对于反应②,既能加快反应又能提高CH4转化率的措施是_____________。
A.升温 B.加催化剂 C.加压 D.吸收CO2
(3)下列情况能说明容器中各反应均达到平衡的是___________。
A.体系中H2O与CH4物质的量之比不再变化
B.体系中H2的体积分数保持不变
C.生成n 个CO2的同时消耗2n个H2O
D. v正(CO)= v逆(H2)
(4)工业重整制氢中,因副反应产生碳会影响催化效率,需要避免温度过高以减少积碳。该体系中产生碳的反应方程式为 _______________。
(5)平衡时升温,CO含量将_________(选填“增大”或“减小”)。
(6)一定温度下 ,平衡时测得体系中 CO2和H2的物质的量浓度分别是0.75mo l/L、4.80mol/L , 则此时体系中CO 物质的量浓度是_______ mol/L。
(7)改变上述平衡体系的温度,平衡时H2O与CH4物质的量之比[ ]值也会随着改变,在图中画出其变化趋势。________________
]值也会随着改变,在图中画出其变化趋势。________________
-
我国在南海北部神弧海域进行的可燃冰试采成功,这标志着我国成为全球第一个实现了在海域可燃冰试开采中获得连续稳定产气的国家。可燃冰主要成分是甲烷,可以用作燃料和制氢原料。甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整两个过程。发生的主要反应如下:
| 化学方程式 | 焓变ΔH/(kJ·mol-1) | 活化能Ea/(kJ·mol-1) |
| 甲烷氧化 | CH4(g)+2O2(g) CO2(g)+2H2O(g) CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g) CO2(g)+2H2(g) CO2(g)+2H2(g) | -322.0 | 172.5 |
| 蒸气重整 | Ⅰ.CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | +206.2 | 240.1 |
| Ⅱ.CH4(g)+2H2O(g) CO2(g)+4H2(g) CO2(g)+4H2(g) | +165 | 243.9 |
下列说法不正确的是
A.CO(g)+H2O(g) CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
B.反应Ⅱ逆反应活化能Ea=78.9kJ·mol-1
C.初始阶段:甲烷氧化的速率大于甲烷蒸气重整的速率
D.甲烷自热重整方法的突出优点是能量循环利用
-
据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,有以下三种:
部分氧化:CH4(g)+  O2(g)
O2(g) CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
水蒸气重整:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH2=205.9kJ·mol-1 ②
CO(g)+3H2(g) ΔH2=205.9kJ·mol-1 ②
CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
二氧化碳重整:CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH4 ④
2CO(g)+2H2(g) ΔH4 ④
则:反应②自发进行的条件是________________,ΔH4 =_____________kJ·mol-1。
(2)水蒸汽重整是较为传统的甲烷制氢途径。在Fe2O3-Ni-gel催化下,CH4和H2O的混合气体进行反应,测得气体的成分随温度、压强、S/C (水蒸气和甲烷的体积比)的变化分别如图1、图2、图3所示:
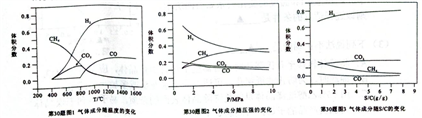
①下列说法正确的是____________。
A.800℃~1000℃,CO2体积分数减小,原因是温度升高抑制了反应③
B.温度升高对氢气的生成有促进作用,温度越高,氢气的产率也越大
C.随着压强的增大,CH4的平衡转化率增大
D.其他条件相同时,将S/C由1增加至3,可提高CH4的平衡转化率及CO2和CO的体积分数
②综合考虑,甲烷水蒸汽重整制氢合适的温度是_____________、压强是______________。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可表示平衡常数(记作KP)。请在下图画出反应①KP1随温度变化的趋势曲线。___________
(4)以多孔石墨为阳极,以NaCl和NaOH的混合溶液作电解液,用电解法由甲烷制取甲醇。写出阳极的电极反应式:______________。
-
据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,有以下三种:
部分氧化:CH4(g)+  O2(g)
O2(g) CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
水蒸气重整:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
二氧化碳重整:CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH4 ④
2CO(g)+2H2(g) ΔH4 ④
则反应②自发进行的条件是________________,ΔH4 =_____________kJ·mol-1。
(2)起始向密闭容器中充入一定量的CH4(g)和O2(g),发生反应①。CH4(g)的平衡转化率与温度(T)和压强(P)的关系如图所示。
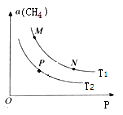
①N、P两点的平衡常数:K(N)_______K(P)(填“>”“<”或“=”),理由是____________________________。
②M、N两点的H2的物质的量浓度c(M)__________c(N)(填“>”“<”或“=”)。
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为____________________(用a、V表示)。
CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为____________________(用a、V表示)。
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等。则b极的电极反应式为___________________;当电路中有3mol电子转移时,质子交换膜两侧溶液相差_________g
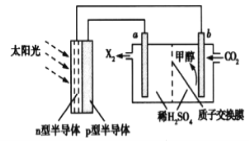 。
。


















 。
。