-
工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下:
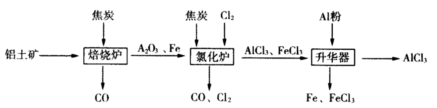
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为_______。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为 。充分反应后温度降至_____以下(填“183℃、315℃之一),开始分离收集AlCl3。
②将AlCl3· 6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的 (填字母序号)。
①氧化性 ②吸水性 ③难挥发性 ④脱水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式________,与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al): m(Pb)=__________________。
-
工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下
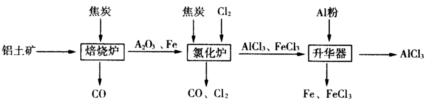
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s)  2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s)  2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s)  4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3。时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为:____________________________。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为_______________。充分反应后温度降至____________以下(填“183℃、315℃之一),开始分离收集AlCl3。
②将AlCl3· 6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的____(填字母序号)。
①氧化性 ②吸水性 ③难挥发性 ④脱水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式 ________;与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al):m(Pb)=_________________。
-
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:

已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华
(1)铝原子的结构示意图为________,实验室配制氯化铝溶液时加入盐酸的目的是________________________。
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为______________________ 炉气中残余有少量Cl2,请画出吸收Cl2的尾气装置图_____。

(3)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围________________。
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
m克样品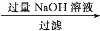 NaAlO2溶液
NaAlO2溶液 Al(OH)3
Al(OH)3 n克Al2O3
n克Al2O3
NaAlO2溶液与过量二氧化碳反应的离子方程式为:______________________。计算该样品中Al的质量分数________(结果用m、n表示,不必化简)。
-
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要
成分是Al2O3和Fe2O3)和焦炭制备,流程如下:
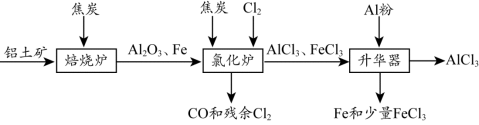
已知:AlCl3、FeCl3 分别在183℃、315℃时升华
(1)Cl2的电子式 。
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为 ;炉气中残余的少量Cl2,可用NaOH溶液吸收,其离子方程式为 。
(3)700℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围 。
a. 低于183℃ b. 介于183℃和315℃之间 c. 高于315℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。

计算该样品中AlCl3的质量分数 (结果用m、n表示,不必化简)。
-
无水AlCl3易升华,可用作有机合成的催化剂等.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是C)为原料制备无水AlCl3的工艺(碳氯化法)流程如下:
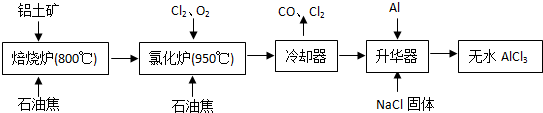
(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为______ 2A1C13+3CO
-
无水AICl3可用作有机合成的催化剂,食品膨松剂等。工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:

(1)在焙烧炉中发生反应:①Fe2O3(S) +3C(s) 2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s) 2Fe(s)+3CO2(g).
2Fe(s)+3CO2(g).
则反应②的平衡常数的表达式为K= ________。
(2)Al2O3、Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3时转移________mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为:________。
(3)升华器中发生反应的化学方程式为 ________。
(4)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱去结晶水制备无水AICl3,此反应必须在氯化氢的气流中加热,其原因是________。
已知SOCl2为无色液体且极易与水反应生成HC1和SO2,AlC13·6H2O与SOCl2混合加热可制取无水AlCl3,写出该反应的化学方程式:________。
-
无水AlCl3可用作有机合成的催化剂,食品膨松剂等。已知AlCl3、FeCl3分别在183℃、315℃时升华,无水AlCl3遇潮湿空气即产生大量白雾。
I.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:
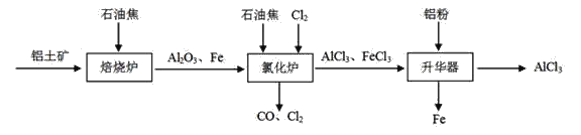
(1)焙烧炉中发生反应:①Fe2O3(s)+3C(s) 2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
则反应②的平衡常数的表达式为K=_____。
(2)氯化炉中Al2O3、Cl2和C在高温下发生反应的化学方程式为_____;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为____。
(3)精制无水AlCl3的合格品中,AlCl3的质量分数不得低于96%。现称取16.25g精制后的无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。该样品中AlCl3的质量分数为_____。
II.实验室可用下列装置制备无水AlCl3。装置B、C中应盛放的试剂名称分别为_____、_____,F中所盛放试剂的作用是_____。
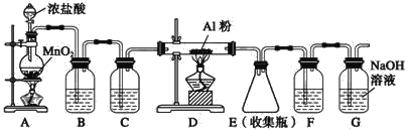
-
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下图所示流程进行一系列反应来制备无水AlCl3。
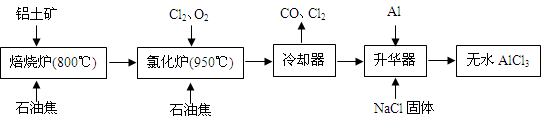
(1)氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则AlCl3是:________晶体,其结构式为:________。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式是________。
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,此反应的离子方程式为:________。
(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是:________。
(5)AlCl3产品中Fe元素含量直接影响其品质,为测定产品中Fe元素的含量,现称取16.25g无水AlCl3产品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重残留固体质量为0.32g。则产品中Fe元素的含量为:________。
-
工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:

已知:
| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | NaCl |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 801 |
回答下列问题:
(1)高温反应前,常在800℃焙烧铝土矿,使固体中水分挥发、气孔数目增多,其作用是 ___(只要求写出一种)。
(2)高温反应后,铝土矿中的氧化物均转变为相应的氯化物,由Al2O3、C和Cl2反应生成AlCl3的化学方程式为 。
(3)气体II的主要成分除了Cl2外,还含有 。气体II常用过量冷的NaOH溶液吸收,吸收液中含有的阴离子主要有 。
(4)工业上为了降低生产成本,生产过程中需要控制加入铝粉的量,“废渣”的主要成分是 。
(5)AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl-4和Al2Cl-7两种离子在电极上相互转化,其它离子不参与电极反应,电镀时阴极的电极反应式为 。
-
工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:
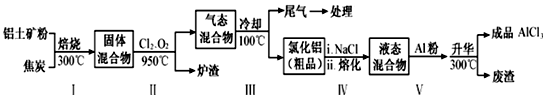
| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
(1)步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是_________________(只要求写出一种)。
(2)步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是________________。
(3)结合流程及相关数据分析,步骤V中加入铝粉的目的是________________。
(4)称取含Fe2O3和Al2O3的试样0.2000g,将其溶解在pH=2.0的热溶液中(50℃左右),以磺基水杨酸为指示剂,用0.02000 mol/L EDTA标准溶液滴定试样中的Fe3+,用去18.00 mL。然后将试液调至pH=3.5,加入上述EDTA标准溶液25.00 mL,并加热煮沸,使Al3+与EDTA完全反应,再调试液pH=4.5,以PAN(1-(2-吡啶偶氨)-2-萘酚)为指示剂,趁热用CuSO4标准溶液(每毫升含CuSO4·5H2O 0.005000g)返滴定,用去8.00 mL。计算试样中Fe2O3和Al2O3的质量分数。________________(写出计算过程)
(已知:EDTA与Fe3+、Al3+、Cu2+均按物质的量之比1∶1进行反应)

2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
4Fe(s)+3CO2(g) △H=___________kJ/mol。


 NaAlO2溶液
NaAlO2溶液







