-
对于一般的化学反应:aA十bB=cC + d D存在速率方程v=k[c(A)]m[c(B)]n,利用速率方程可算得化学反应的瞬时速率;为反应级数,当m+n分别等于0、1、2……时分别称为零级反应、一级反应、二级反应…,k为反应速率常数,k与温度、活化能有关,与浓度无关。
Ⅰ.1073K时,反应:2NO(g) +H2(g)=N2(g) +2H2O(g)的实验数据如下表所示:
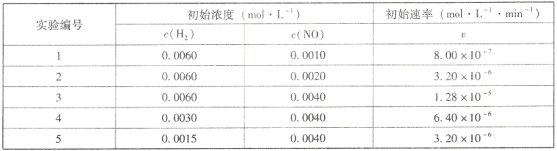
通过分析表中实验数据,得该反应的速率方程表达式v=____________,为____________级反应。
Ⅱ.已知可逆反应A(g) B(g)的正、逆反应均为一级反应,且存在如下数据:
B(g)的正、逆反应均为一级反应,且存在如下数据:

试回答下列问题:
(1)600K时反应的平衡常数K=____________;
(2)正反应的△H____________0(填“>”或“<”)。
(3)850K时在容积为VL的恒容密闭容器中充入3 mol气体A,一段时间后达平衡。下列说法正确的是____________ (填序号)。
A.恒温条件下,再向容器内加入一定量的气体A,达到新平衡时,A的转化率减小,体积分数增大
B.升高温度,k正、k逆均增大,且k逆增大幅度大
C.使用催化剂,k正、k逆均增大,且比值不变
D.达平衡后的任意时段内,正、逆反应的平均速率为零、瞬时速率也为零
E.平衡时,混合气体的平均摩尔质量与起始时相同
F.若在同温、同体积的恒容密闭绝热容器中,充入1.5 mol气体B,达平衡时,A的浓度为上述平衡时的一半
(4)600K时,在容积为1L的恒容密闭容器中充入2mol气体A,已知反应过程中物质的浓度、速率常数和反应时间之间满足如下关系:2.30lg =(k正+k逆)t,[c0(A)为反应物A的起始浓度,ct(A)、ct(B)分别为A, B任意时刻的浓度,k为反应速率常数,t为反应时间〕,则:
=(k正+k逆)t,[c0(A)为反应物A的起始浓度,ct(A)、ct(B)分别为A, B任意时刻的浓度,k为反应速率常数,t为反应时间〕,则:
①t =__________min时反应达平衡。
②反应一段时间后A, B浓度相等,则这段时间内正反应的平均反应速率v=_________ mol/( L·min)(保留整数);此时,逆反应的瞬时速率v=_________mol/( L·min) (已知lg2=0.3, lg5=0.7)
-
某学习小组的同学在学习了化学反应速率与化学平衡知识后,对反应:aA(g)+bB(g) cC(g)+dD(g)
cC(g)+dD(g)  H,反应特点与对应的图象展开了讨论,其中不正确的是
H,反应特点与对应的图象展开了讨论,其中不正确的是

A.图①中,若P1>P2,则该反应在较低温度下有利于自发进行
B.图②中,若T2>T1,则 H<0且a+b=c+d
H<0且a+b=c+d
C.图③中( /表示正反应速率,
/表示正反应速率, //表示逆反应速率),t1时刻改变的条件一定是使用了催化剂
//表示逆反应速率),t1时刻改变的条件一定是使用了催化剂
D.图④中,若 H<0,则纵坐标不可能表示的是反应物的转化率
H<0,则纵坐标不可能表示的是反应物的转化率
-
在某固定容积的密闭容器中充入1mol A,一定条件下建立如下化学平衡:aA(g) bB(g)+cC(g),在温度不变的条件下,再充入一定量的A物质。下列说法正确的是
bB(g)+cC(g),在温度不变的条件下,再充入一定量的A物质。下列说法正确的是
A.在建立新平衡的过程中,A分解的速率与B消耗的速率之比为a :b
B.在建立新平衡的过程中,混合气体的密度逐渐减小
C.重新达平衡时,A的转化率一定增大
D.若a=b+c,重新达平衡时,B的体积分数不变
-
在某固定容积的密闭容器中充入1mol A,一定条件下建立如下化学平衡:aA(g) bB(g)+cC(g),在温度不变的条件下,再充入一定量的A物质。下列说法正确的是
bB(g)+cC(g),在温度不变的条件下,再充入一定量的A物质。下列说法正确的是
A.在建立新平衡的过程中,A分解的速率与B消耗的速率之比为a :b
B.若a=b+c,重新达平衡时,B的体积分数不变
C.重新达平衡时,A的转化率一定增大
D.在建立新平衡的过程中,混合气体的密度逐渐减小
-
对于反应aA+bB=dD+eE,该化学反应速率定义为 。式中
。式中 指物质
指物质 的反应速率,
的反应速率, 、
、 、
、 、
、 是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
| 实验编号 | 1 | 2 | 3 | 4 |
| c(HI)/ mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 |
| c(H2O2)/ mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 |
| v/ mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 |
以下说法正确的是
A.实验1、2中, (H2O2)相等
(H2O2)相等
B.将浓度均为0.200 mol·L-1H2O2和HI溶液等体积混合,反应开始时 =0.0304 mol·L-1·s-1
=0.0304 mol·L-1·s-1
C. 与“HI和H2O2浓度的乘积”的比值为常数
与“HI和H2O2浓度的乘积”的比值为常数
D.实验4,反应5秒后H2O2浓度减少了0.0755 mol·L-1
-
下列图示与对应的叙述相符的是
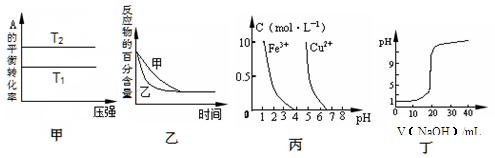
A.由图甲可以判断:对于反应aA(g)+ bB(g) cC(g),若T1>T2, 则a +b=c且 H<0
cC(g),若T1>T2, 则a +b=c且 H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1000 mol/L NaOH溶液滴定20.00 mL0.1000 mol/L醋酸溶液得到的滴定曲线
-
如图图示与对应的叙述相符的是

A.由图甲可以判断:对于反应aA(g)+bB(g)⇌cC(g),若T1>T2,则a+b=c且△H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g)⇌3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/L醋酸溶液得到的滴定曲线
-
可逆反应aA(g)+bB(g) cC(g)+dD(s);△H=QkJ·mol-1,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、反应速率(v)与压强的关系如图所示。据图分析,以下说法正确的是
cC(g)+dD(s);△H=QkJ·mol-1,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、反应速率(v)与压强的关系如图所示。据图分析,以下说法正确的是
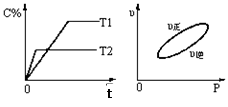
A.T1<T2,Q>0
B.增大压强,B的转化率减小
C.当反应达平衡时,混合气体的密度不再变化
D.a+b>c+d
-
可逆反应aA(g)+bB(g) cC(g)+dD(s);△H=QkJ·mol-1,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、反应速率(v)与压强的关系如图所示。据图分析,以下说法正确的是
cC(g)+dD(s);△H=QkJ·mol-1,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、反应速率(v)与压强的关系如图所示。据图分析,以下说法正确的是

A.T1<T2,Q>0
B.增大压强,B的转化率减小
C.当反应达平衡时,混合气体的密度不再变化
D.a+b>c+d
-
A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g) cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:
cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:
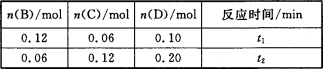
下列说法正确的是
A.0~t1时间段内,平均反应速率v(B)=O.04/t1 mol·(L·min)-1
B.若起始时n(D)=0,则t2时v(D)=0.20/t2 mol·(L·min)-1
C.升高温度,v(B)、vC)、v(D)均增大
D.b:d=6:1

B(g)的正、逆反应均为一级反应,且存在如下数据:

=(k正+k逆)t,[c0(A)为反应物A的起始浓度,ct(A)、ct(B)分别为A, B任意时刻的浓度,k为反应速率常数,t为反应时间〕,则:




