-
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |
(1)同温度下,等pH值的a.NaHCO3 b.NaCN c.Na2CO3溶液的物质的量浓度由大到小的顺序为_____________(填序号)。
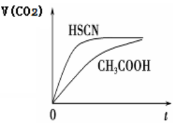
(2)25℃时,将20mL 0.1mol·L-1 CH3COOH溶液和20mL 0.1mol·L-1 HSCN溶液分别与20mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
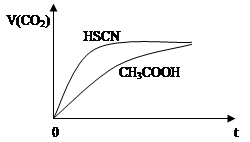
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:_______________。反应结束后所得两溶液中,c(SCN—) c(CH3COO—)(填“>”、“<”或“=”)
(3)若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是________(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数
-
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
(1)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为______________(填序号)。
(2) 25℃时,将20mL0.1mol/LCH3COOH 溶液和20mL0.1mol/LHSCN 溶液分别与20mL0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V) 随时间(t) 的变化如右图所示,反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是________。反应结束后所得两溶液中,c (CH3COO-) ____c (SCN-) (填“>”、“<”或“=")。
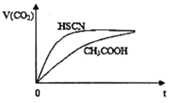
(3)若保持温度不变,在醋酸溶液中加少量盐酸,下列量会变小的是___ (填序号)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
-
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |
(1)同温度下,等pH值的a.NaHCO3 b.NaCN c.Na2CO3溶液的物质的量浓度由大到小的顺序为_____________(填序号)。
(2)25℃时,将20mL 0.1mol·L-1 CH3COOH溶液和20mL 0.1mol·L-1 HSCN溶液分别与20mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
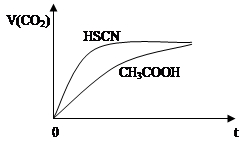
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:______________________。
反应结束后所得两溶液中,c(SCN—) c(CH3COO—)(填“>”、“<”或“=”)
(3)若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是______________(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数
-
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 | H2SO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
(1)25℃时,将20mL 0.1mol·L-1 CH3COOH溶液和20mL 0.1mol·L-1 HSCN溶液分别与20mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
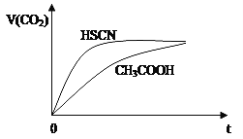
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:__________________________
(2)若保持温度不变,在CH3COOH溶液中加入一定量氨气,下列量会变小的是____(填序号)
A.c(CH3COO-) B.c(H+)C.Kw D.醋酸电离平衡常数
(3)若保持温度不变,将pH均为3的HCl与HSCN的溶液分别加水稀释100倍,此时c(Cl-)_____c(SCN-) (填“>、=、<”,后同),两溶液的导电性:HCl _______HSCN
(4)将足量的NaHSO3溶液加入Na2CO3溶液中,反应的离子方程式为___________________________
-
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)等物质的量浓度的 A.CH3COONa、B.NaCN、C.Na2CO3、D.NaHCO3溶液的pH由大到小的顺序为____________(填字母)。
(2)常温下, 0.1 mol·L-1的CH3COOH 溶液加水稀释,下列表达式的数据变大的是______。
A.C(H+) B.C(H+)/C(CH3COOH) C.C(H+)·C(OH-)
(3)25 ℃时,将 20 mL 0.1 mol·L-1 CH3COOH 溶液和 20mL0.1 mol·L-1HSCN溶液分别与20mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是____________; 反应结束后所得两溶液中,(CH3COO-)________c(SCN-)(填“>”、 “<”或“=”)
(4)25 ℃时,在 CH3COOH 与 CH3COONa 的混合溶液中,若测得 pH=6,则溶液中c(CH3COO-)-c(Na+)=__________mol·L-1(填精确值), c(CH3COO-)/c(CH3COOH)=_________。
(5)用离子方程式表示Na2CO3溶液呈碱性的原因_____________________________。
-
(18分)已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为___ _____(填字母)。
(3)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填序号)
A.[H+] B.[H+]/[CH3COOH] C.[H+]·[OH-] D.[OH-]/[H+]
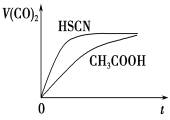
(4)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20mL0.1 mol·L -1HSCN溶液分别与20 mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
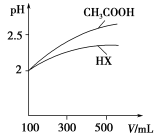
(5)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(6)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确值),
c(CH3COO-)/c(CH3COOH)=________。
(7)写出少量CO2通入次氯酸钠溶液中的离子方程式:_____________________________。
-
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | HSCN | CH3COOH | HCN | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:Ka1=____________。
(2)物质的量浓度均为0.1mol/L的六种溶液:
A.CH3COONa、b.Na2CO3、c.NaClO、D.NaHCO3、e.NaSCN f.NaCN
pH由大到小的顺序为___________(用编号填写)。
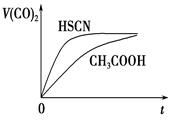
(3)25℃时,将20mL0.1mol·L-1CH3COOH溶液和20mL0.1mol·L-1HSCN溶液分别与20mL 0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
(4)25℃时,NaCN与HCN的混合溶液,若测得pH=8,则溶液中
c(Na+)-c(CN-)=________mol/L(填代入数据后的计算式,不必算出具体数值)。
c(CN-)/c(HCN)=____________(填代入数据后的计算式,不必算出具体数值)。
(5)向NaClO溶液中通入少量的CO2,发生反应的离子方程式为_____________。
(6) 25C时,0.18mol/L醋酸钠溶液的pH约为______________。
-
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7
K2=5.6×10-11 |
根据上述电离常数分析,下列错误的是( )
A.25℃时,等物质的量浓度的各溶液pH关系为:pH(HCN)>pH(H2CO3)>pH(CH3COOH)
B.2NaCN+H2O+CO2=2HCN+Na2CO3
C.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a一定大于b
D.2CH3COOH+Na2CO3=2 CH3COONa+H2O+CO2↑
-
已知 25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列有关说法正确的是
A. 1 mol·L-1HCN溶液与1mol·L-1 NaOH溶液等体积混合后,测得所得溶液显酸性
B. 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
C. NaHCO3溶液中,一定有c(Na+)=c(HCO3-)+c(CO32-)
D. 1mol/L醋酸溶液加水稀释,所有离子浓度均减小
-
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、n(H+)、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,存在c(Na+)+ c(H+)=c(OH—)+ c(HCO3-) +2c(CO32-)







