-
某学生欲通过实验方法验证 Fe2+的性质.
(1)该同学在实验前,依据Fe2+的 性,填写了表格.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红综色气体,溶液颜色逐渐变黄 | Fe2++NO +2H+═Fe3++NO2↑+H2O +2H+═Fe3++NO2↑+H2O |
依照表中操作,该同学进行实验,观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.为了进一步探究溶液变为深棕色的原因,该同学进行如下实验.
(2)向原新制FeSO4溶液和反应溶液后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是 .
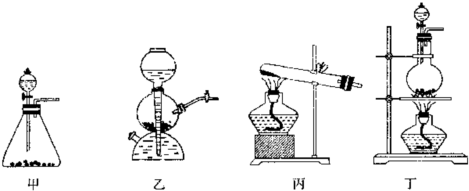
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.

ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.ⅲ为与ⅰ中实验进行对照,更换丙丁后,使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是 ;
②装置乙的作用是 ;
③步骤ⅱ目的是 ;
④该实验可得出的结论是 .
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是 .
-
(15分)某学生欲通过实验方法验证Fe2+的性质。
(1)该同学在实验前,依据Fe2+的 性,填写了下表。
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO +2H+ =Fe3++NO2↑+H2O +2H+ =Fe3++NO2↑+H2O |
依照表中操作,该同学进行实验。观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色。
为了进一步探究溶液变成深棕色的原因,该同学进行如下实验。
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者(加了数滴浓硝酸的FeSO4溶液)变红。该现象的结论是 。
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究。
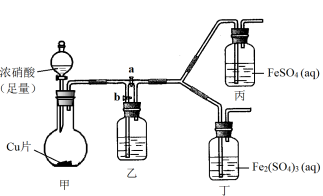
ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
ⅲ.为与ⅰ中实验进行对照,更换丙、丁后(溶质不变),使甲中反应继续,观察到的现象与步骤ⅰ中相同。
①铜与足量浓硝酸反应的化学方程式是 ;
②装置乙的作用是 ;
③步骤ⅱ的目的是 ;
④该实验可得出的结论是 。
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是 。
-
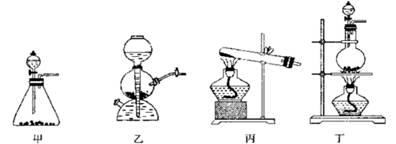
某研究性学习小组同学设计了如下图制取氯气并验证其性质的实验装置。
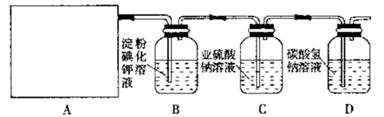
请回答下列问题:
(1)该实验中A部分的装置是________(填写装置的序号)

(2)A中发生反应一段时间后,B中的现象是;
整套实验装置存在的明显缺陷是。
(3)写出D装置中发生反应的离子方程式:________。
(4)请你帮该小组同学设计一个实验,证明洗气瓶C中的 已被氧化(简述实验步骤):。
已被氧化(简述实验步骤):。
-
某研究性学习小组同学设计了如图制取氯气并验证其性质的实验装置.
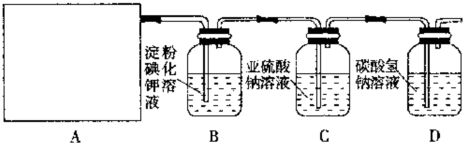
请回答下列问题:
(1)该实验中A部分的装置是______(填写装置的序号)
(2)A中发生反应一段时间后,B中的现象是______;整套实验装置存在的明显缺陷是______.
(3)写出D装置中发生反应的离子方程式:______.
(4)请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):______.
-
某研究性学习小组同学设计了如图制取氯气并验证其性质的实验装置.

请回答下列问题:
(1)该实验中A部分的装置是______(填写装置的序号)
(2)A中发生反应一段时间后,B中的现象是______;整套实验装置存在的明显缺陷是______.
(3)写出D装置中发生反应的离子方程式:______.
(4)请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):______.
-
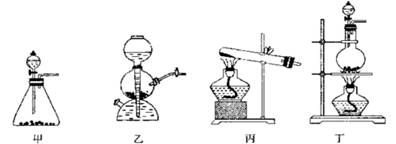
(10分) 某研究性学习小组同学设计了如下图制取氯气并验证其性质的实验装置。

请回答下列问题:
(1)该实验中A部分的装置是________(填写装置的序号)
(2)A中发生反应一段时间后,B中的现象是;
整套实验装置存在的明显缺陷是。
(3)写出D装置中发生反应的离子方程式:________。
(4)请你帮该小组同学设计一个实验,证明洗气瓶C中的 已被氧化(简述实验步骤):________。
已被氧化(简述实验步骤):________。
-
(12分) 某研究性学习小组同学设计了如下图制取氯气并验证其性质的实验装置。

请回答下列问题:
(1)该实验中A部分的装置是________(填写装置的序号)
(2)A中发生反应一段时间后,B中的现象是________;
整套实验装置存在的明显缺陷是。
(3)写出D装置中发生反应的离子方程式:________。
(4)写出C装置中发生反应的离子方程式:________。请你帮该小组同学设计一个实验,证明洗气瓶C中的 已被氧化(简述实验步骤):________
已被氧化(简述实验步骤):________
-
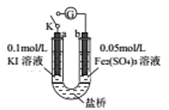
某同学用下图实验装置验证通过改变浓度来实现反应,2Fe3++2I-=2Fe2++I2中Fe3+与Fe2+的相互转化。K 闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴油加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反。下列有关说法不正确的是( )
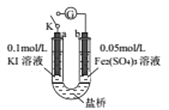
A. 指针第一次偏转时,b极反应式为Fe3++e-=Fe2+
B. 加入AgNO3后,a为正极
C. 当b极有0.001molFe3+被还原时,则通过盐桥的电子数为0.001NA
D. 第二次指针偏转的原因是:I-浓度减小,反应逆向进行
-
某同学用下图实验装置验证通过改变浓度来实现反应,2Fe3++2I-=2Fe2++I2中Fe3+与Fe2+的相互转化。K 闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴油加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反。下列有关说法不正确的是( )
A. 指针第一次偏转时,b极反应式为Fe3++e-=Fe2+
B. 加入AgNO3后,a为正极
C. 当b极有0.001molFe3+被还原时,则通过盐桥的电子数为0.001NA
D. 第二次指针偏转的原因是:I-浓度减小,反应逆向进行
-
某校化学实验兴趣小组为了验证在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),请按要求回答下列问题。
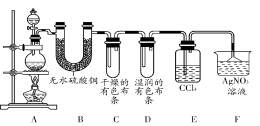
(1)下列方法中,可制得Cl2的正确组合是 。
①MnO2和浓盐酸混合共热;②MnO2、NaCl和浓硫酸混合共热;③NaClO和浓盐酸混合;④K2Cr2O7和浓盐酸混合;⑤KClO3和浓盐酸混合共热;⑥KMnO4和浓盐酸混合。
A.①②⑥ B.②④⑥
C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式 。
(3)①装置B的作用是 ;
②装置C和D出现的不同现象说明的问题是 ;
③装置E的作用是 。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置 与 之间(填装置字母序号)增加一个装置,所增加装置里面的试剂可以为 (填字母序号)。
A.湿润的碘化钾淀粉试纸 B.浓硫酸
C.湿润的红色布条 D.饱和食盐水。














