-
(14分)
以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质 )为原料回收MnO2的工艺流程如下:
I. 将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II. 将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
III. 向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV. 向III所得溶液(pH约为6)中缓慢滴加0.50 mol•L-1 Na2CO3溶液,过滤,得滤渣b,其主要成分为MnCO3;
V. 滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι中Ag与足量稀HNO3反应生成NO的化学方程式为 。
(2)已知II的灼烧过程中同时发生反应:
MnO2(s) + C(s) === MnO(s) + CO (g) △H = +24.4 kJ • mol – 1 ①
MnO2(s) + CO(g) === MnO(s) + CO2(g) △H = -148.1 kJ • mol – 1 ②
写出MnO2和C反应生成MnO和CO2的热化学方程式: 。
(3)H2O2分子中含有的化学键类型为 、 。
(4)III中MnO2溶解的离子方程式为 ,溶解一定量的MnO2,H2O2的实际消耗量比理论值高,用化学方程式解释原因: 。
(5)IV中,若改为“向0.50 mol•L-1 Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中会混有较多Mn(OH)2沉淀,解释其原因: 。
(6)V中MnCO3在空气中灼烧的化学方程式为 。
高三化学简答题中等难度题查看答案及解析
-
以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质 )为原料回收MnO2的工艺流程如下:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II.将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV. 向III所得溶液(pH约为6)中缓慢滴加0.50 mol•L-1 Na2CO3溶液,过滤,得滤渣b,其主要成分为MnCO3;
V. 滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι中Ag与足量稀HNO3反应生成NO的化学方程式为____________________。
(2)已知II的灼烧过程中同时发生反应:
MnO2(s)+C(s) = MnO(s) + CO (g) △H=+24.4 kJ • mol -1
MnO2(s)+CO(g) = MnO(s)+CO2(g) △H=-148.1 kJ • mol -1
写出MnO2和C反应生成MnO和CO2的热化学方程式:________。
(3)H2O2分子中含有的化学键类型为________、________。
(4)III中MnO2溶解的离子方程式为________,溶解一定量的MnO2,H2O2的实际消耗量比理论值高,用化学方程式解释原因:______________________________________。
(5)IV中,若改为“向0.50 mol•L-1 Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中会混有较多Mn(OH)2沉淀,解释其原因:________________________________________。
(6)V中MnCO3在空气中灼烧的化学方程式为________。
高三化学综合题中等难度题查看答案及解析
-
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可以得到多种化工原料。有关数据如下表所示:
溶解度/(g/100 g水)
温度/ ℃
化合物
0
20
40
60
80
100
NH4Cl
29.3
37.2
45.8
55.3
65.6
77.3
ZnCl2
343
395
452
488
541
614
化合物
Zn(OH)2
Fe(OH)2
Fe(OH)3
Ksp近似值
10-17
10-17
10-39
回答下列问题:
(1)该电池的正极反应式为________________________________________,
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过加热浓缩、冷却结晶分离回收;滤渣的主要成分是MnO2、C和MnOOH,欲从中得到较纯的MnO2,最简便的方法是_______,
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀H2SO4和H2O2溶解,加碱调节至pH为________时,铁刚好沉淀完全(离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全,若上述过程不加H2O2后果是__________原因是_____________________。
高三化学综合题中等难度题查看答案及解析
-
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如下表示:
溶解度/(g/100g水)
温度/℃
化合物
0
20
40
60
80
100
NH4Cl
29.3
37.2
45.8
55.3
65.6
77.3
ZnCl2
343
395
452
488
541
614
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为___。
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过___分离回收;滤渣的主要成分是MnO2、___和___,欲从中得到较纯的MnO2,最简便的方法为___,其原理是___。
高三化学综合题中等难度题查看答案及解析
-
(14分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
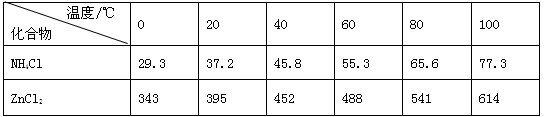
化合物
Zn(OH)2
Fe(OH)2
Fe(OH)3
Ksp近似值
10-17
10-17
10-39
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
高三化学简答题极难题查看答案及解析
-
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
温度/℃
化合物
0
20
40
60
80
100
NH4Cl
29.3
37.2
45.8
55.3
65.6
77.3
ZnCl2
343
395
452
488
541
614
化合物
Zn(OH)2
Fe(OH)2
Fe(OH)3
Ksp近似值
10-17
10-17
10-39
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
高三化学填空题极难题查看答案及解析
-
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:溶解度/(g/100g水)
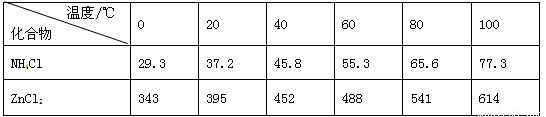
化合物
Zn(OH)2
Fe(OH)2
Fe(OH)3
Ksp近似值
10-17
10-17
10-39
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为 。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过 __ 分离回收;滤渣的主要成分是MnO2、_ __ __和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_ ____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为 _时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
高三化学简答题极难题查看答案及解析
-
锌锰废电池可回收锌、锰元素生产硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:

试回答下列问题:
(1)硫酸锌水溶液显酸性,用离子方程式说明______.
(2)原料锰粉粗品中主要成分为MnO2和碳,焙烧时反应的化学方程式为MnO2+C=MnO+CO↑,该反应的氧化产物是______.
(3)50-55℃向MnS04的母液中加入足量NH4HC03,反应的化学方程式为:
MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+______+______.
(4)已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6.下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:实验操作 离子方程式 步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡.
______步骤2:将pH调到______,使Fe3+沉淀完全 Fe3++3H2O⇌Fe(OH)3+3H+ 高三化学解答题中等难度题查看答案及解析
-
锰酸锂离子蓄电池是第二代锂离子动力电池。一种以软锰矿浆(主要成分为MnO2,含少量 Fe2O3、FeO、A12O3、SiO2等杂质)为原料制备锰酸锂的流程如下图所示。
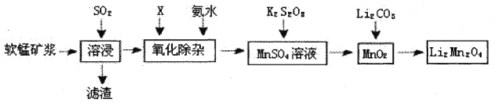
(1)溶浸生产中为提高SO2回收率可采取的措施有_________(填序号)
a.不断搅拌,使SO2和软锰矿浆充分接触
b.增大通入SO2的流速
c.减少软锰矿浆的进入量
d.减小通入SO2的流速
(2)已知:室温下,Ksp[A1(OH)3]=1×10-33,Ksp[Fe(OH)3]=l×10-39, pH=7.1 时 Mn(OH)2开始沉淀。氧化除杂时(室温)除去MnSO4液中的Fe3+、Al3+(使其浓度小于1× l0-6mol /L),需调节溶液pH范围为_______。
(3)由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生反应的离子方程式___________。
(4)将MnO2和 Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600℃〜750℃,制取产品LiMn2O4。写出该反应的化学方程式 _____________ 。
(5)锰酸锂可充电电池的总反应为:Li1-xMn2O4+LixC
LiMn2O4+C(0<x<1)
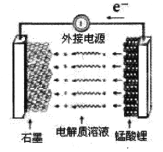
①充电时,电池的阳极反应式为_________,若此时转移lmole-,则石墨电极将增重______g。
②废旧锰酸锂电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是________。
高三化学综合题困难题查看答案及解析
-
锰酸锂离子蓄电池是第二代锂离子动力电池。一种以软锰矿浆(主要成分为MnO2,含少量 Fe2O3、FeO、A12O3、SiO2等杂质)为原料制备锰酸锂的流程如下图所示。
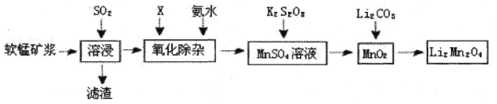
(1)溶浸生产中为提高SO2回收率可采取的措施有_________(填序号)
a.不断搅拌,使SO2和软锰矿浆充分接触
b.增大通入SO2的流速
c.减少软锰矿浆的进入量
d.减小通入SO2的流速
(2)已知:室温下,Ksp[A1(OH)3]=1×10-33,Ksp[Fe(OH)3]=l×10-39, pH=7.1 时 Mn(OH)2开始沉淀。氧化除杂时(室温)除去MnSO4液中的Fe3+、Al3+(使其浓度小于1× l0-6mol /L),需调节溶液pH范围为_______。
(3)由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生反应的离子方程式___________。
(4)将MnO2和 Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600℃〜750℃,制取产品LiMn2O4。写出该反应的化学方程式 _____________ 。
(5)锰酸锂可充电电池的总反应为:Li1-xMn2O4+LixC
LiMn2O4+C(0<x<1)
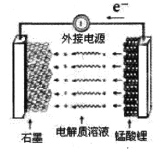
①充电时,电池的阳极反应式为_________,若此时转移lmole-,则石墨电极将增重______g。
②废旧锰酸锂电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是________。
高三化学综合题困难题查看答案及解析