-
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可以得到多种化工原料。有关数据如下表所示:
溶解度/(g/100 g水)
| 温度/ ℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为________________________________________,
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过加热浓缩、冷却结晶分离回收;滤渣的主要成分是MnO2、C和MnOOH,欲从中得到较纯的MnO2,最简便的方法是_______,
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀H2SO4和H2O2溶解,加碱调节至pH为________时,铁刚好沉淀完全(离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全,若上述过程不加H2O2后果是__________原因是_____________________。
-
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如下表示:
溶解度/(g/100g水)
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为___。
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过___分离回收;滤渣的主要成分是MnO2、___和___,欲从中得到较纯的MnO2,最简便的方法为___,其原理是___。
-
(14分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
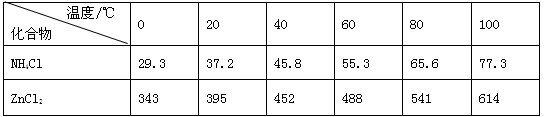
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
-
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
|  温度/℃ 温度/℃
化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
-
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:溶解度/(g/100g水)
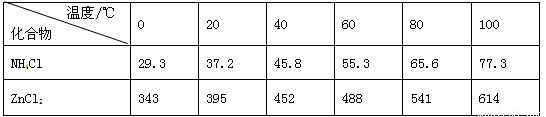
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为 。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过 __ 分离回收;滤渣的主要成分是MnO2、_ __ __和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_ ____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为 _时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
-
酸性锌锰电池是一种一次性电池。其中的黑色粉末是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物,该电池放电过程产生MnOOH。下列有关回收处理该废电池的描述不正确的是
A. 对黑色粉末进行溶解、过滤都需要用到玻璃棒
B. 将滤渣放在坩埚中充分灼烧后,可得到锰的化合物
C. 将滤液加热蒸干,由于NH4Cl 分解,可得到ZnCl2固体
D. 实验室可利用“升华”的方法分离ZnCl2(s)和NH4Cl(s)
-
(14分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下图所示:
溶解度/(g/100g水)
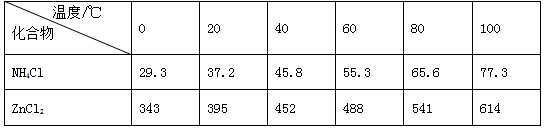
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的负极为 ,正极反应式为 ,
(2)维持电流强度为0.5A,电池工作5分钟,理论消耗Zn g(已知F=96500C/mol)。
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过 分离回收,滤渣的主要成分是二氧化锰、 和 ,欲从中得到较纯的二氧化锰,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为 加碱调节PH为 ,铁刚好完全沉淀(离子浓度≤1×10-5mo1·L-1时即可认为离子沉淀完全)继续加碱调节PH为 锌开始沉淀(假定此时溶液中Zn2+的浓度为0.1 mo1·L-1)。若上述过程不加双氧水的后果 ,原因是 。
-
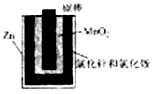
如图a酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,下列说法不正确的是

有关数据如下表所示:
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
A.该电池的正极反应式为MnO2+eˉ+H+=MnOOH
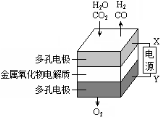
B.利用干电池,高温电解H2O–CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1
C.废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离
D.废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法
-
如图a酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,下列说法不正确的是
有关数据如下表所示:
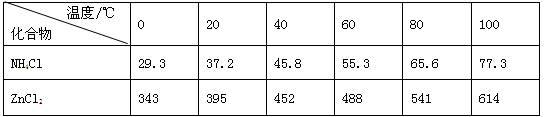
图a 图b
A.该电池的正极反应式为MnO2+eˉ+H+==MnOOH
B.利用干电池,高温电解H2O—CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1
C.废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离
D.废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法
-
锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸。工作时正极上会发生反应:2NH4++2e-=2NH3↑+H2↑。电池总反应为:2MnO2(s)+ Zn(s)+NH4+(aq)=2MnO(OH)(s)+[Zn(NH3)2]2+(aq)。
请回答下列问题:
(1)电池的负极反应式为 。
(2)对干电池不能进行加热或充电,否则会 。
(3)废电池糊状填充物经溶解、过滤,得到无色滤液和黑色滤渣。某课外活动小组对该滤液和滤渣进行了探究。已知:滤液的成份是氯化锌和氯化铵;Zn(OH)2是两性氢氧化物。
I.取少量滤液于试管中,滴入适量NaOH溶液产生白色沉淀至沉淀刚开始溶解,并字不要微热,生成无色刺激性气体和,检验该气体的方法是 。继续往试管中滴入FeCl3溶液,白色沉淀部分转化为红褐色沉淀,则可判断Zn(OH)2的Ksp Fe(OH)3的Ksp(填“大于”、“小于”、“不能判断”),写出该反应的离子方程式 。
II.从黑色滤渣分离出二氧化锰,探究其在用H2O2制备O2过程中的作用。实验装置如图所示,将等量的H2O2溶液加入烧瓶中,分别进行2次实验(气体体积在相同条件下测定)。
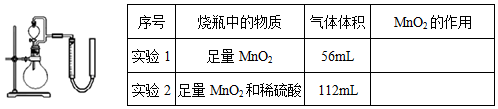
为了准确读取量气管读数,读数时视线应与左管凹液面最低处相平,还应注意 ,实验1中MnO2的作用是催化剂,则实验2中反应的离子方程式为 。
用废电池的锌皮制作七水合硫酸锌(含少量金属铁),其流程如下:
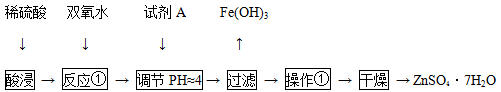
试剂A是 (填化学式),操作①包括 、冷却结晶、过滤、洗涤等操作,其过程中所需的仪器有酒精灯、玻璃棒、漏斗和下列仪器中的 (填字母)。(铁架台及夹持仪器略)
坩埚 B.蒸发皿 C.圆底烧瓶 d.小烧杯
(5)ZnSO4·7H2O晶体溶解于饱和Na2CO3溶液中,得到6.46g的碱式碳酸锌[Znx(CO3)y(OH)z],为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式 。








