-
(6分)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3 mol·L-1。现抽取某人血样10ml。稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3 mol·L-1 KMnO4溶液与溶解得到的草酸恰好完全反应。据此可以求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常。(提示2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O)
(1)配制5.0×10-3 mol·L-1 KMnO4 200mL溶液,需要称取KMnO4固体的质量是 g;
(2)每消耗草酸0.5mol,转移电子的物质的量为 mol;
(3)此人血液中的Ca2+的浓度为 mol·L-1。
高一化学计算题中等难度题查看答案及解析
-
钙元素是人体必须的常量元素,所有细胞都需要钙元素。正常人体血液中钙离子浓度为2.2x10-3mol/L~2.71x10-3mol/L.。请回答下列问题。
(1)血液中钙离子浓度高于或等于2.75x10-3mol/L 称为高血钙症。一个成年人全身血液总量约为4L,则高血钙病人血液中的钙离子至少为 mol;
(2)如果以“g/L”表示,正常人体血液中钙离子浓度的最小值为 g/L;
(3)草酸钙(CaC2O4)难溶于水,是人体内结石的主要成分,其摩尔质量为 g/mol;豆腐中含有较多钙盐(如硫酸钙),硫酸钙的电离方程式是 ;菠菜、洋葱中含有丰富的草酸钠(Na2C2O4),硫酸钙与草酸钠反应的化学方程式是 ,由此说明生活中上述食物正确的食用方法是 。
高一化学填空题中等难度题查看答案及解析
-
(1)用单线桥表示下列反应中电子转移方向和数目:
KIO3+6HI =KCl+3H2O+3I2
(2)钙元素是人体必需的常量元素,所有的细胞都需要钙元素,测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C204+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是__________;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂__________ mol,有__________ mol电子发生转移,相当于测出含钙元素的质量是_____g。
高一化学填空题中等难度题查看答案及解析
-
补钙是人类保健的热点,人体需要摄入一定量钙元素。关于钙离子与钙原子的比较正确的是( )
A. 质量Ca2+比Ca大 B. 半径Ca2+比Ca大
C. 电子Ca2+比Ca少 D. 质子Ca2+比Ca少
高一化学单选题简单题查看答案及解析
-
Se是人体必需微量元素,
的原子核内中子数和核外电子数之差是( )
A. 34 B. 78 C. 44 D. 10
高一化学选择题中等难度题查看答案及解析
-
铬用于制不锈钢,汽车零件,工具,磁带和录像带等。铬是人体必需的微量元素,铬的生理功能是与其它控制代谢的物质一起配合起作用,如激素、胰岛素、各种酶类、细胞的基因物质(DNA和RNA)等,但铬在人体内超过一定浓度对人体健康会造成伤害。
(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。
请用离子方程式说明上述除杂的原理__________________。
(2)工业上为了处理含有Cr2O2- 7的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为__________。
②常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH至少为 ,才能使Cr3+低于1×10-5 mol·L-1(国家允许的排放标准之内)。
③现用上述方法处理100m3含铬(+6价)78mg•L-1的废水,需用绿矾的质量为 kg。(保留到
小数点后一位)
高一化学填空题中等难度题查看答案及解析
-
公认的人体必需金属元素是钠和钾。在动物中,钠主要是以氯化钠形式存在于细胞外液中,依靠氯化钠可以把一定量的水吸到细胞里来,使细胞里维持一定的水分。某试剂瓶上贴有如下标签,对该试剂理解正确的是 ( )
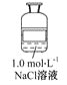
A.该溶液中含有的微粒主要有NaCl、Na+、Cl-、H2O
B.若取50毫升溶液,其中的c(Cl-)=0.05 mol·L-1
C.若取该溶液与100 mL 0.1 mol·L-1AgNO3溶液完全反应,需要取该溶液10 mL
D.该溶液与1.0 mol·L-1Na2SO4溶液的c(Na+)相等
高一化学单选题中等难度题查看答案及解析
-
生活或实验中常碰到一些化学知识,下列分析中不正确的是:
A. 人体不能缺碘,需要正常补碘。“加碘食盐”中的“碘”是指碘元素
B. 进行焰色反应实验时,蘸取样品之前需要用稀硫酸溶液清洗铂丝
C. “绿色化学”的理想在于不再使用有毒、有害的物质,不再产生废物
D. 水壶中产生的水垢可用食醋清洗除去
高一化学null简单题查看答案及解析
-
生活或实验中常碰到一些化学知识,下列分析中不正确的是
A. 人体不能缺碘,需要正常补碘,“加碘食盐”中的“碘”是指碘元素
B. 进行焰色反应实验时,蘸取样品之前需要用稀硫酸溶液清洗铂丝
C. “绿色化学”的理想在于不再使用有毒、有害的物质,不再产生废物
D. 水壶中产生的水垢(主要成分为CaCO3和Mg(OH)2)可用食醋清洗除去
高一化学单选题简单题查看答案及解析
-
人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(Ca2C2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液定量反应即可测定血样样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
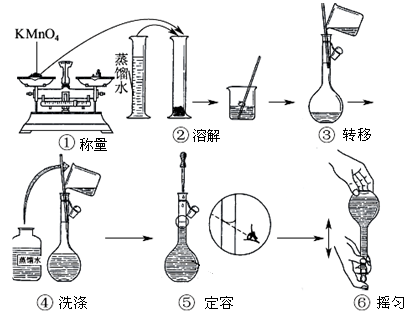
【实验探究一】配制酸性KMnO4标准溶液。如上图所示是配制100mL 酸性KMnO4 标准溶液的过程示意图。
(1)请你观察图示判断其中不正确的操作有____________(填序号);
(2)其中确定100mL溶液体积的容器是____________(填名称);
(3)如果按照图示的操作所配制溶液进行实验,在其他操作均正确的情况下,所得KMnO4溶液浓度将_________(填“偏大”或“偏小”)。
【实验探究二】测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L 酸性KMnO4 溶液与之反应,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为:2MnO4- +5H2C2O4+6H+═2Mnx++10CO2↑+8H2O则式中的x=_________
(5)经过计算,血液样品中Ca2+的浓度为___________ mg/cm3。
高一化学实验题困难题查看答案及解析