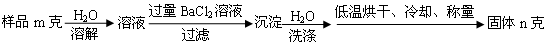-
(14分)氨在国防、工农业等领域发挥着重要作用。
(1)工业以甲烷为原料生产氨气的过程如下:
①过程Ⅰ中,有关化学反应的能量变化如下图所示
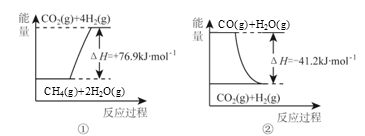
反应①为 反应(填“吸热”或“放热”),CH4 (g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是 。
②CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:
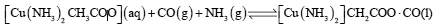 ,所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是 。(选填字母)。
,所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是 。(选填字母)。
a.高温、高压 b.高温、低压
c.低温、低压 d.低温、高压
③下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
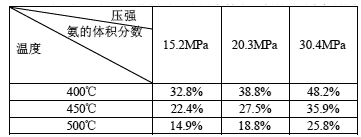
Ⅰ.根据表中数据,得出的结论是 。
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n (N2)= 0.1mol,
n(H2)= 0.3mol。下列图象能正确表示该过程中相关量的变化的是 。(选填字母)。
(2)直接供氨式固体氧化物燃料电池能量转化率达85%,其结构示意图如图所示:
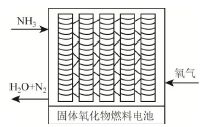
①负极的电极反应式是______。
②用该电池电解300ml的饱和食盐水。一段时间后,溶液pH=13(忽略溶液体积的变化),则消耗NH3溶液的体积是_____L。(标准状况)
-
氨在国防、工农业等领域发挥着重要作用。工业以甲烷为原料生产氨气的过程如下:
(1)过程Ⅰ中,有关化学反应的能量变化如下图所示
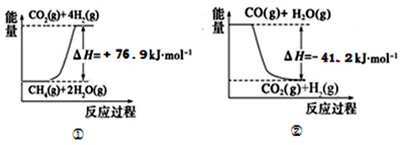
反应①为___________(“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式是________________。
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ )溶液吸收,其反应原理为:[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO•CO(1),
[Cu(NH3)3]CH3COO•CO(1), 
①N元素在周期表中的位置为__________,NH3的电子式为__________。
②所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是__________(选填字母)。
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
(3)合成NH3的反应为放热反应,如果该反应平衡时,只改变一个条件,再次达到新平衡时,平衡常数K值变大。关于该反应的说法正确的是__________(填字母序号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大再减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小再增大
(4)400℃,28MPa时,将1molN2和3mol H2混合充入体积可变的密闭容器中,加入催化剂,10分钟后反应达到平衡时N2转化率为60%。该温度下的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
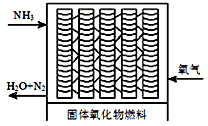
(5)一种直接供氨式固体氧化物燃料电池能量转化率达85%,其结构示意图如图所示:
①负极的电极反应式是_____________。
②用该电池电解300mL的饱和食盐水。一段时间后,溶液pH=13(忽略溶液体积的变化),则消耗NH3溶液的体积是_____L。(标准状况)
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
(1)氨气的电子式为___,它的共价键属于___(填“极性”或“非极性”)键,其溶于水显碱性的理由是(用化学方程式表示)___。
(2)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且一定使平衡混合物中NH3的体积分数增大的是___。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(3)常温下,向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。

表示NH3·H2O浓度变化的曲线是___(填“A”或“B”)。
(4)当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=___mol/L(用数字表示)。若液氨中也存在类似水的电离(H2O+H2O H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
①写出液氨的电离方程式:___。
②写出碳酸钠溶于液氨后第一级氨解的离子方程式:___。
③写出碳酸钠的液氨溶液中各离子浓度的大小关系:___。
-
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家.
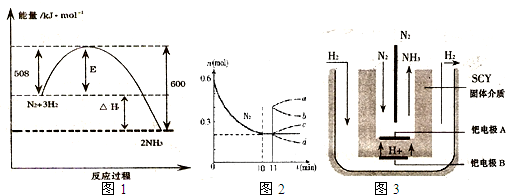
(1)如图1表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
①写出氮气与氢气合成氨的热化学反应方程式:______ 2NH3(g)△H═-92kJ/mol
-
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
 (1)右图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
(1)右图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
①写出氮气与氢气合成氨的热化学反应方程式:________
②对于合成氨的反应下列说法正确的是________(填编号)
A.该反应在任意条件下都可以自发进行
B.加入催化剂,能使该反应的E和△H都减小

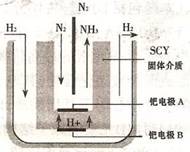 (3)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下吧氢气和用氦气稀释的氮气,分别通人一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质理用吸附在它内外表面上的金属但多晶薄膜像电噪,实现了常压、570℃条件下高转化率的电解法合成氮(装置如图)。
(3)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下吧氢气和用氦气稀释的氮气,分别通人一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质理用吸附在它内外表面上的金属但多晶薄膜像电噪,实现了常压、570℃条件下高转化率的电解法合成氮(装置如图)。
请回答:铠电极是电解池的________极(填"阳"或"阴"),该极上的电极反应式是________
-
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家.

(1)如图1表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
①写出氮气与氢气合成氨的热化学反应方程式:______ 2NH3(g)△H═-92kJ/mol
-
【化学选修2化学与技术】(15分)氨气是工农业生产中重要的产品,合成氨并综合利用的某些过程如下图所示:
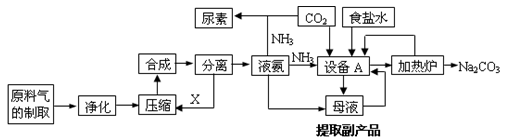
(1)原料气中的氢气来源于水和碳氢化合物。请写出甲烷和水在催化剂和高温条件下反应的方程式: 。
(2)在工业生产中,设备A的名称为 ,A中发生的化学反应方程式是 。
(3)上述生产中向母液通入氨气同时加入 ,可促进副产品氯化铵的析出。长期使用氯化铵会造成土壤酸化,尿素适用于各种土壤,在土壤中尿素发生水解,其水解的化学方程式是 。
(4)纯碱在生产生活中有广泛的应用,请写出任意两种用途: 。
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
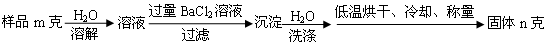
①检验沉淀是否洗涤干净的方法是_________________________________。
②样品中NaCl的质量分数的数学表达式为__________________________。
-
(15分) [选修2—化学与技术]氨气是工农业生产中重要的产品,合成氨并综合利用的某些过程如下图所示:
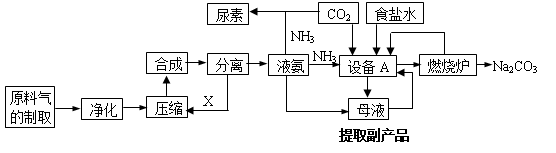
(1)原料气中的氢气来源于水和碳氢化合物。请写出甲烷和水在催化剂和高温条件下反应的方程式: 。
(2)在工业生产中,设备A的名称为 ,A中发生的化学反应方程式是 。
(3)上述生产中向母液通入氨气同时加入 ,可促进副产品氯化铵的析出。长期使用氯化铵会造成土壤酸化,尿素适用于各种土壤,在土壤中尿素发生水解,其水解的化学方程式是 。
(4)纯碱在生产生活中有广泛的应用,请写出任意两种用途: 。
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。

①检验沉淀是否洗涤干净的方法是_____________。
②样品中NaCl的质量分数的数学表达式为________________。
-
氨和甲烷等原料在工业生产中发挥着重要的作用。
Ⅰ.我国科学家以MoS2 为催化剂,通过调节催化剂/电解质的表界面相互作用,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图所示。
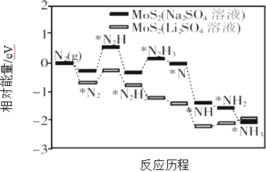
(1)将Na2SO4 溶液换成Li2SO4 溶液后,反应速率明显加快的主要原因是加快了下列____________转化的反应速率(填标号)。
A.N2→*N2 B.*N2→*N2H C.*N2H3→*N D.*NH→*NH2
Ⅱ. 甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g) CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(2)已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH1=akJ·mol—1,
2CO(g)+O2(g)= 2CO2(g) ΔH2=b kJ·mol—1,
2H2(g) +O2(g)=2 H2O (l) ΔH3=c kJ·mol—1
CO(g)+ H2O(g)= CO2(g)+ H2 (g) ΔH4=d kJ·mol—1
则甲烷水蒸气重整反应的ΔH=____________kJ·mol—1(用字母a、b、c、d表示)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2物质的量分数与水碳比、平衡温度的关系如图所示:

①结合如图回答:当平衡温度一定时,H2的物质的量分数与水碳比(1~10)的关系是________,其原因是_____________。
②若密闭容器中仅发生CH4(g)+H2O(g) CO(g)+3H2(g),平衡温度为750℃,水碳比为1.0时,H2的物质的量分数0.5,甲烷的转化率为___________,其压强平衡常数Kp为________;用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2),则此时反应速率v=_________。(已知:气体分压=气体的物质的量分数×总压,速率方程中k 为速率常数)。
CO(g)+3H2(g),平衡温度为750℃,水碳比为1.0时,H2的物质的量分数0.5,甲烷的转化率为___________,其压强平衡常数Kp为________;用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2),则此时反应速率v=_________。(已知:气体分压=气体的物质的量分数×总压,速率方程中k 为速率常数)。
Ⅲ.利用天然气合成氨,并生产尿素的流程如下:
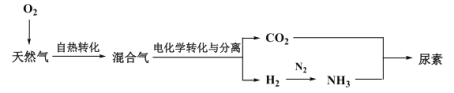
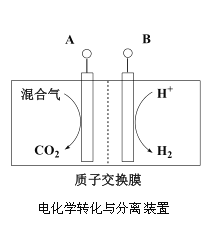
(3)“电化学转化与分离”装置如图,混合气中CO转化成CO2的电极反应式为______。
-
氮的化合物在某些领域中扮演着重要的角色.
(1)氨和铵盐在粮食的增产中发挥着极其重要的作用,同时又是重要的工业原料.
①写出实验室制取氨气的化学方程式:______;
②常温下,向25mL 0.1mol•L-1HA溶液中逐滴加入0.2mol•L-1NH3•H2O溶液,曲线如图所示(体积变化忽略不计).由图确定HA是______(填“强”或“弱”)酸,HA与NH3•H2O恰好完全反应时,混合溶液中由水电离出的c(H+)______(填“>”、“>”或“=”)0.1mol•L-1HA溶液中由水电离出的c(H+);写出C点时混合溶液中各离子浓度由大到小的顺序为______;
(2)未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机.这类材料中研究得较多的是氮化物A.粉末状A能够与水反应,所得产物中有一种酸性氧化物,它是工业上生产玻璃的主要原料,另一种产物是氨气.请写出A与水反应的化学方程式______;
(3)硝酸是医药、军事、化工等领域的重要原料.在实验室中,将适量铁铜混合粉末与稀硝酸充分反应后得到溶液X.若有固体剩余,实验测得溶液X中大量存在的阳离子只有两种,则阳离子为______(写离子符号);若反应后无固体剩余,某同学认为X中除Fe3+、Cu2+外还可能含有Fe2+,若要确认其中的Fe2+,应选用______(选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.酸性KmnO4溶液 d.浓氨水.


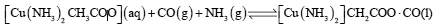 ,所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是 。(选填字母)。
,所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是 。(选填字母)。






 (1)右图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
(1)右图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
 (3)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下吧氢气和用氦气稀释的氮气,分别通人一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质理用吸附在它内外表面上的金属但多晶薄膜像电噪,实现了常压、570℃条件下高转化率的电解法合成氮(装置如图)。
(3)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下吧氢气和用氦气稀释的氮气,分别通人一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质理用吸附在它内外表面上的金属但多晶薄膜像电噪,实现了常压、570℃条件下高转化率的电解法合成氮(装置如图)。