-
己二酸是一种重要的化工原料和合成中间体。已知:室温下,己二酸微溶于水,当温度由28℃升至78℃时,其溶解度可增大20倍。某实验小组利用绿色氧化剂H2O2氧化环己烯合成己二酸,反应和制备装置如下:

主要实验步骤:
①在100mL三颈烧瓶中依次加入1.50g钨酸钠0.57g草酸和34mL30%过氧化氢溶液,室温下磁力搅拌20min。
②用恒压滴液漏斗缓慢加入8.0mL的环己烯,继续搅拌并加热回流2 小时,停 止加热。
③将反应液迅速转入烧杯中,冷却至室温后再用冰水浴冷却,有大量晶体析出。抽滤,并用少量冰水洗涤,即可得到己二酸晶体粗品。
回答下列问题:
(1)本实验中使用带刻度的恒压滴液漏斗的主要作用有_________、_________。
(2)步骤③中用冰水洗涤晶体的目的是______________________________________。
己二酸晶体粗品可利用_________方法进一步获得纯品。
(3)取0.1480g 己二酸(Mr=146.0)样品置于250mL锥形瓶中,加入50mL蒸馏水溶解,再加入2滴指示剂,用0.1000mol/Ld的NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为20.00 mL。
①本实验应选择_________(填“甲基橙”“石蕊”或“酚酞”)溶液作指示剂。
②判断滴定终点的方法是_________________________。
③样品中己二酸的质量分数为_________%(保留4位有效数字)。
(4)实验小组通过改变环己烯的用量来探究物料比对产率的影响,实验结果如下图所示。
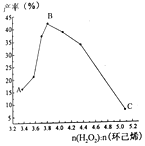
结合图像分析产率变化的可能原因:
①A点→B点:___________________________________________;
②B点→C点:____________________________________________。
-
依折麦布是目前唯一的胆固醇吸收抑制剂,合成它的一种重要中间体M的结构如图所示。某兴趣小组以甲苯和戊二酸酐为原料,设计了以下合成路线,部分条件和产物已略去。
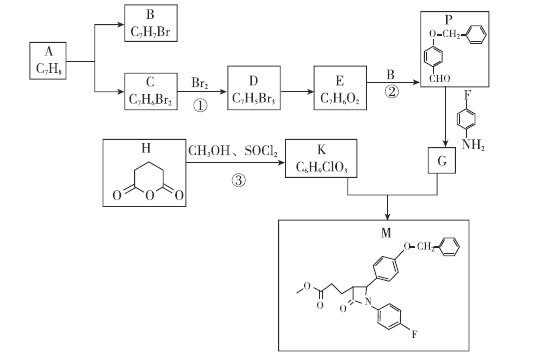
已知:
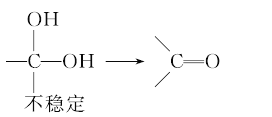

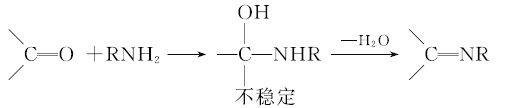

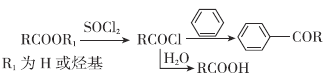
请回答:
 物质K的结构简式为___________________。
物质K的结构简式为___________________。
 下列说法正确的是____________。
下列说法正确的是____________。
A.由甲苯制B需用Fe作催化剂
B.物质H水解后产物的最简单同系物为乙酸
C.反应 均为取代反应
均为取代反应
D.1mol物质K最多能与2mol NaOH反应
 写出反应
写出反应 的化学方程式:__________________________________________________。
的化学方程式:__________________________________________________。
 写出同时符合下列条件的G的所有同分异构体的结构简式:______________________。
写出同时符合下列条件的G的所有同分异构体的结构简式:______________________。
 分子中含有3个苯环;
分子中含有3个苯环;  能发生银镜反应;
能发生银镜反应; 酸性条件下能发生水解反应;
酸性条件下能发生水解反应;  谱显示分子中含有6种氢原子。
谱显示分子中含有6种氢原子。
 设计以苯和乙烯为原料制备另一种医药中间体二苯甲酮
设计以苯和乙烯为原料制备另一种医药中间体二苯甲酮

 的合成路线:_______________________________________________________。
的合成路线:_______________________________________________________。 用流程图表示,无机试剂任选
用流程图表示,无机试剂任选
-
1,4-环己二酮是一种重要的医药、液晶中间体。以工业原料乙烯为基础的1,4-环已二酮(G)合成线路如图所示:
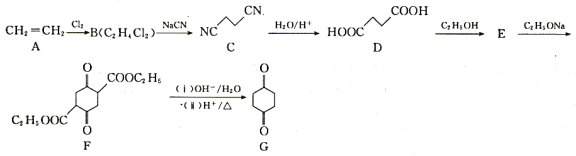
已知:2RCH2COOC2H5 +C2H5OH
+C2H5OH
(1)B和E的结构简式分别为________、________。
(2)B→C的反应类型为________。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,用星号(*)标出F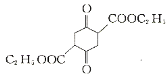 中的手性碳________。
中的手性碳________。
(4)由E→F的化学方程式为________。
(5)同时满足下列条件的G的同分异构体的结构简式________(不考虑立体异构)。
①能发生银镜反应;
②核磁共振氢谱显示为2个峰,且峰面积之比为3:1。
(6)设计由乙烯(CH2=CH2)和乙醇(C2H5OH)制备 的合成路线________(无机试剂任选)
的合成路线________(无机试剂任选)
-
1,6— 己二酸(G)是合成尼龙的重要原料之一,可用六个碳原子的化合物氧化制备。下图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F)。
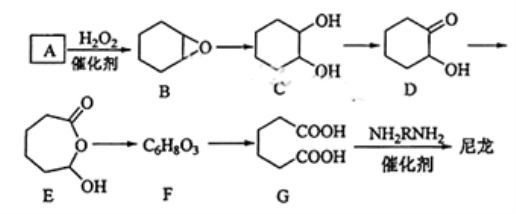
回答下列问题:
(1)化合物A中含碳87.8%,其余为氢,A的化学名称为________________。
(2)B到C的反应类型为________________。
(3)F的结构简式为________________。
(4)在上述中间物质中,核磁共振氢谱出峰最大的是_________,最少的是__________(填化合物代号)。
(5)由G合成尼龙的化学方程式为_________________________。
(6)由A通过两步制备1,3—环己二烯的合成线路为_____________________。
(7) 有机物C的同分异构体属于酯类的有 种
-
(16分)间硝基苯胺(Mr=128)是一种重要的染料中间体。它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇。间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原,其反应式如下:
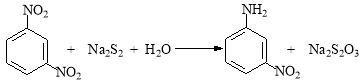
已知:R-NH2 + H+ → R-NH3+
实验步骤:
①在100mL锥形瓶中加入8g结晶硫化钠与30mL水,搅拌溶解。再加入2g硫黄粉,缓缓加热并不断搅拌到硫黄粉全部溶解,冷却后备用。
②在150mL三颈烧瓶中加入4.74g间二硝基苯(Mr=158)与40mL水,安装机械搅拌装置、滴液漏斗和回流冷凝管如图所示,将步骤①配制的多硫化钠溶液加入滴液漏斗。
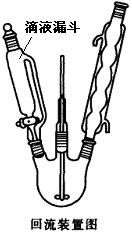
③加热三颈烧瓶至瓶内微微沸腾,开动搅拌使间二硝基苯与水形成悬浮液。慢慢滴加多硫化钠溶液,滴加完毕后继续搅拌回流30min。移去热源,用冷水浴使反应物迅速冷却到室温后,减压过滤,滤饼洗涤三次。
④在150mL某容器中配制稀盐酸(30mL水加7mL浓盐酸),将上述粗产物转移进该容器,加热并用玻璃棒搅拌,使间硝基苯胺溶解,冷却到室温后减压过滤。
⑤冷却滤液,在搅拌下滴加过量浓氨水到pH=8,滤液中逐渐析出黄色的间硝基苯胺。
⑥冷却到室温后减压过滤,洗涤滤饼到中性,抽干,产物重结晶提纯,在红外灯下干燥,称重,得2.56g。
回答下列问题:
(1)滴液漏斗较普通分液漏斗的优点 ;第④步中配制稀盐酸的容器名称为 。
(2)间二硝基苯和间硝基苯胺都有毒,因此该实验应在 内进行。
(3)在铁和盐酸作用制得初生态氢原子(还原性远强于碱金属多硫化物)也可以将硝基还原为氨基,却未被采用,其可能原因为 。
(4)第④步用盐酸溶解粗产品,而不用水的原因 。
(5)第③步中滤饼洗涤三次,可选用的洗涤剂为( );第⑥步产物要进行重结晶,可选用的试剂为( )。
A.冷水 B.热水 C.乙醚 D.乙醇
(6)第③步中,搅拌使间二硝基苯与水形成悬浮液后再滴加多硫化钠溶液,其原因为 。
(7)第⑥步中要将滤饼洗涤到中性,检验方法为 。
(8)该反应的产率为 。
-
1,6-己二酸(G)是合成尼龙的重要原料之一,可用六个碳原子的化合物氧化制备.如图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F).回答问题:
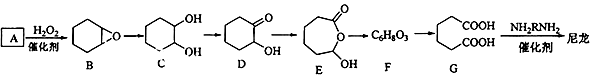
(1)化合物A中含碳87.8%,其余为氢,A的化学名称为__________________;
(2)B到C的反应类型为_______________;
(3)F的结构简式为___________________;
(4)在上述中间物质中,核磁共振氢谱中峰最多的是______,最少的是__________(填化合物代号,可能有多选)。
(5)由G合成尼龙的化学方程式为______________________;
(6)由A通过两步制备1,3﹣环己二烯的合成线路为______________(样式:A条件和试剂B一定条件 C)。
(7)有机物C的同分异构体属于酯类的有_________种.
-
1,6-己二酸(G)是合成尼龙的重要原料之一,可用六个碳原子的化合物氧化制备.如图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F).回答问题:

(1)化合物A中含碳87.8%,其余为氢,A的化学名称为__________________;
(2)B到C的反应类型为_______________;
(3)F的结构简式为___________________;
(4)在上述中间物质中,核磁共振氢谱中峰最多的是______,最少的是__________(填化合物代号,可能有多选)。
(5)由G合成尼龙的化学方程式为_______________________;
(6)由A通过两步制备1,3﹣环己二烯的合成线路为______________(样式:A条件和试剂B一定条件 C)。
(7)有机物C的同分异构体属于酯类的有_________种.
-
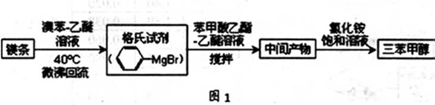
三苯甲醇( )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示。
已知:i)格氏试剂容易水解,
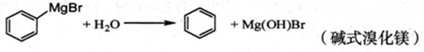
ii)相关物质的物理性质如下:
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| 三苯甲醇 | 164.2 | 380 | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | —116.3 | 34.6 | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | —30.7 | 156.2 | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 | —34.6 | 212.6 | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 |
iii)三苯甲醇的相对分子质量是260,纯净固体有机物一般都有固定熔点。
请回答以下问题:
(1)实验室合成三苯甲醇的装置图2,写出玻璃仪器A的名称:________,装有无水CaCl2的仪器A的作用是:________;
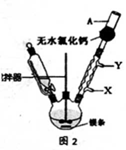
(2)制取格氏试剂时要保持微沸,可以采用水浴加热,优点是________,微沸回流时冷凝管中水流的方向是:________(填“X→Y”或“Y→X”);
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等 杂质,可以设计如下提纯方案,请填写空白:
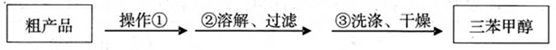
其中,操作①为:________;洗涤液最好选用:________;
A.水 B.乙醚 C.乙醇 D.苯
检验产品已经洗涤干净的操作为:________;
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80m L(标准状况)。产品中三苯甲醇质量分数为________ (保留两位有效数字,已知三苯甲醇的分子式为C19H16O,相对分子质量为260)。
-
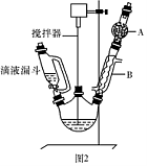
(15分)三苯甲醇( )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。

已知:(I)格氏试剂容易水【解析】
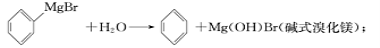
(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性[ |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
(Ⅲ)三苯甲醇的相对分子质量是260。
请回答以下问题:
(1)装置中玻璃仪器B的名称为 ;装有无水CaCl2的仪器A的作用是 。
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持温度约为40℃,可以采用 加热方式。
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:
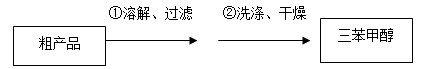
其中,洗涤液最好选用 (填字母序号)。
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为 。
-
(15分)三苯甲醇( )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。


已知:(I)格氏试剂容易水【解析】

(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
(Ⅲ)三苯甲醇的相对分子质量是260。
请回答以下问题:
(1)装置中玻璃仪器B的名称为 ;装有无水CaCl2的仪器A的作用是 。
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持温度约为40℃,可以采用 加热方式。
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:

其中,洗涤液最好选用 (填字母序号)。
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为 。







 +C2H5OH
+C2H5OH 中的手性碳________。
中的手性碳________。




 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示。


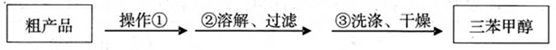
 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。

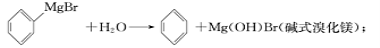

 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。

