-
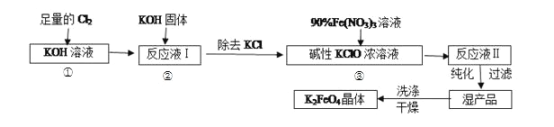
(13分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:
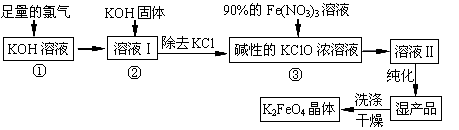
回答下列问题:
(1)反应①应在温度较低时进行,这是由于Cl2与KOH溶液在温度较高时反应生成KClO3,写出加热时该反应的化学方程式 。
(2)在溶液I中加入KOH固体的目的是 (填字母)。
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,同时得到副产品 (写化学式);判断K2FeO4晶体已经洗涤干净的方法是
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,请写出该反应的离子方程式:
(5)若消耗90%的硝酸铁溶液268.9g,则理论上可制得K2FeO4晶体 g
-
(18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2 反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3 、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是: FeO42¯ + H2O = Fe(OH)3(胶体) + O2↑ +
完成并配平上述反应的离子方程式。
-
高铁酸钾(K2FeO4) 是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
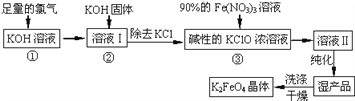
(1)反应①应在温度较低的情况下进行(因在温度较高时KOH 与Cl2 反应生成的是KClO3。)写出①的化学方程式_____________________。
(2)在溶液I中加入KOH 固体的目的是_____________________。(填编号)
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH 固体溶解时会放出较多的热量,有利于反应进行
C.为下一步反应提供碱性的环境
D.使KClO3 转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4 后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为__________________________________________。
(4)如何判断K2FeO4 晶体已经洗涤干净___________________。
-
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下:
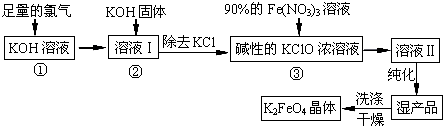
(1)反应①应在温度较低的情况下进行.因在温度较高时KOH 与Cl2 反应生成的是KClO3.写出在温度较高时KOH 与Cl2反应的化学方程式______ KClO3+5KCl+3H2O
-
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
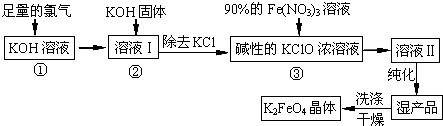
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2 反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式___________,该反应的氧化产物是___________。
(2)在溶液I中加入KOH固体的目的是___________(填编号).
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为___________。
(4)如何判断K2FeO4晶体已经洗涤干净___________。
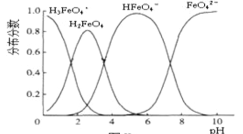
(5)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.其水溶液中FeO42-的存在形态如下图所示.下列说法正确的是( )
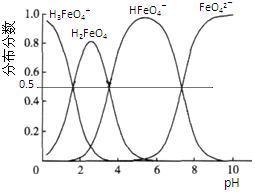
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
-
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
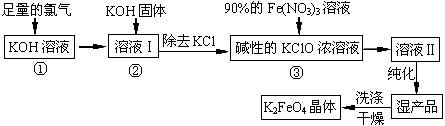
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2 反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式________
________,当反应中转移5 mol电子时,消耗的氯气是mol。
(2)在反应液I中加入KOH固体的目的是(填编号)。
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3 、KCl,则反应③中发生的离子反应方程式为________。
(4)如何判断K2FeO4晶体已经洗涤干净。
-
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2 反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式 ,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3 、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:
FeO42¯ + H2O = Fe(OH)3(胶体) + O2↑ +
完成并配平上述反应的离子方程式。
-
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
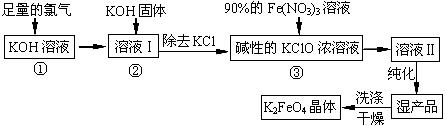
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2 反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式 ,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3 、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是: FeO42¯ + H2O = Fe(OH)3(胶体) + O2↑ + ,完成并配平上述反应的离子方程式。
-
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:

(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式_________________________________,该反应的氧化产物是_______________。
(2)在溶液Ⅰ中加入KOH固体的目的是________________ (填编号)。
A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为_______________________________________________。
(4)如何判断K2FeO4晶体已经洗涤干净______________________________。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:________
___FeO42-+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
-
(10分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。
其生产工艺如下:回答下列问题:

(1)该生产工艺应在_________________(填“温度较高”或“温度较低”)的情况下进行,在溶液I中加入KOH固体的目的是_____________________。
(2)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为________________ _。
(3)高铁酸钾作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
FeO42- + H2O = Fe(OH)3(胶体)+ O2 ↑ + OH-
(4)目前,人们针对K2FeO4的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物K2FeO4水溶液稳定性的是(填代号)_________________。
a.亚硫酸钠 b.KOH c.醋酸 d.Fe(NO3)3

4Fe(OH)3(胶体)+8OH-+3O2↑