-
草酸晶体的组成可用H2C2O4·2H2O(M=126g/mol)表示,其中混有不参与反应的杂质,为了测定草酸晶体的纯度,进行如下实验:称取m g样品,配成250mL水溶液。量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为c mol·L-1的KMnO4溶液滴定,所发生的反应: KMnO4+ H2C2O4+ H2SO4 = K2SO4+ CO2↑+ MnSO4+ H2O.试回答:
(1)写出该反应的离子方程式并配平:_________________________________________,该反应发生时产生气体先慢后快的原因是_______________________________________________
(2)实验中,KMnO4溶液应装在_____式滴定管中,因为 ___________________。
(3)滴定过程中需要加入的指示剂为___________(填指示剂的名称或“不需要”),确定反应达到滴定终点时的现象是______________________________________。
(4)在滴定过程中若用c mol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为____________mol·L-1,由此可计算样品中草酸晶体的纯度是________。
高二化学实验题中等难度题查看答案及解析
-
草酸晶体的组成可用H2C2O4·2H2O(M=126g/mol)表示,其中混有不参与反应的杂质,为了测定草酸晶体的纯度,进行如下实验:称取m g样品,配成250mL水溶液。量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为c mol·L-1的KMnO4溶液滴定,所发生的反应: KMnO4+ H2C2O4+ H2SO4 = K2SO4+ CO2↑+ MnSO4+ H2O。试回答:
(1)写出该反应的离子方程式并配平:_________________________________________,该反应发生时产生气体先慢后快的原因是_______________________________________________
(2)实验中,KMnO4溶液应装在_____式滴定管中,因为 ___________________。
(3)滴定过程中需要加入的指示剂为___________(填指示剂的名称或“不需要”),确定反应达到滴定终点时的现象是______________________________________。
(4)下列操作会导致测定结果偏低的是_________________________。
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(5)在滴定过程中若用c mol·L-1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为___mol·L-1,由此可计算样品中草酸晶体的纯度是________。
高二化学实验题中等难度题查看答案及解析
-
草酸晶体的组成可用H2C2O4•5H2O表示,为了测定某草酸样品中草酸晶体的纯度,进行如下实验:
称取Wg草酸晶体,配成100.00mL水溶液,取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L-1的KMnO4溶液滴定,所发生的反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答:
(1)实验中不需要的仪器有(填序号)________,还缺少的仪器有(填名称)________.
a.托盘天平(带砝码,镊子)b.滴定管 c.100mL量筒 d.铁架台(带滴定管夹) e.烧杯 f.漏斗 g.胶头滴管 h.玻璃棒 i.药匙 j.烧瓶
(2)实验中,标准液KMnO4溶液应装在________式滴定管中,因为________.
(3)实验中用左手控制________(填仪器及部位),眼睛注视________,直至滴定终点.判断到达终点的现象是________.
(4)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是________;若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得结果会________(偏大、偏小、无影响)
(5)在滴定过程中若用amol•L-1的KMnO4溶液VmL,则该样品中草酸晶体的纯度为________.高二化学填空题中等难度题查看答案及解析
-
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程必须用到的2种定量仪器是 ______ 和 ______ .
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液
②酸化KMnO4溶液的酸应为 ______ .(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:_______________________ □MnO4-+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是 ______ .
(3)在上述实验中,下列操作一定会造成测定结果偏低的是 ______ .
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
高二化学实验题中等难度题查看答案及解析
-
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程必须用到的2种定量仪器是 ______ 和 ______ .
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液
②酸化KMnO4溶液的酸应为 ______ .(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:_______________________ □MnO4-+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是 ______ .
(3)在上述实验中,下列操作一定会造成测定结果偏低的是 ______ .
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
高二化学实验题中等难度题查看答案及解析
-
为测定某草酸晶体(H2C2O4•2H2O)样品的纯度,现称取一定质量的该样品,配制成100 mL溶液,取25.00 mL该溶液于锥形瓶中,加适量稀硫酸,用0.100 mol/L的KMnO4溶液滴定(杂质不参与反应)。为省去计算过程,当称取的样品的质量为某数值时,滴定所用KMnO4溶液的毫升数恰好等于样品中草酸晶体的质量分数的100倍。则应称取样品的质量为
A. 2.25 g B. 3.15 g C. 9.00 g D. 12.6 g
高二化学单选题中等难度题查看答案及解析
-
草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:
①称取1.260g纯草酸晶体,将其配制成100.00mL水溶液为待测液.
②取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.试回答:
(1)实验中需要用到的玻璃仪器有:滴定管、100mL量筒、烧杯、胶头滴管、锥形瓶、玻璃棒,其中还缺少的仪器有(填名称及规格)______.
(2)滴定时,将KMnO4标准液装在如图中的______(填“甲”或“乙”)滴定管中.达到滴定终点的现象是______.
(3)在滴定过程中若用去0.1000mol/L的KMnO4溶液10.00mL(已取三次平均值),则所配制的草酸溶液的物质的量浓度为______mol/L,由此可计算x的值是______.
(4)①若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得x值会______填“偏大”、“偏小”或“无影响”,下同).
②若滴定终点时仰视滴定管刻度,则由此测得的x值会______.
高二化学解答题中等难度题查看答案及解析
-
(14分)I.草酸晶体的组成可用H2C2O4·x H2O表示,为了测定x值,进行如下实验:
(1) 称取Wg草酸晶体,配成100.00 mL水溶液
(2) 取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为a mol·L—1的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为:
2 KMnO4 + 5 H2C2O4 + 3 H2SO4 = K2SO4 + 10CO2↑ + 2MnSO4 + 8H2O
试回答:
①在滴定过程中若用去a mol·L—1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为 mol·L—1,由此可计算x的值是 。
②若滴定终点读数时俯视,则计算的x值可能会 (偏大、偏小、无影响)。
Ⅱ.实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
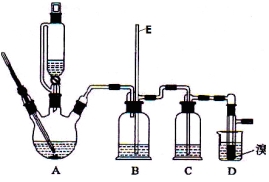
提示:乙醇与浓硫酸在140℃时脱水生成乙醚,在170℃时脱水生成乙烯。
有关数据列表如下:
乙醇
1,2-二溴乙烷
乙醚
状态
无色液体
无色液体
无色液体
密度/g · cm-3
0.79
2.2
0.71
沸点/℃
78.5
132
34.6
熔点/℃
-130
9
-116
回答下列问题:
(1)装置D中发生主要反应的化学方程式为 。
(2)装置B的作用 ,长玻璃管E的作用 。
(3)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字母)。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4) 反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 ;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”)。
(5)若产物中有少量未反应的Br2,最好用 洗涤除去 (填正确选项前的字母) 。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
高二化学实验题困难题查看答案及解析
-
草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x 值,进行如下实验:
①称取wg草酸晶体,配成100.00 mL水溶液。
②量取25.00 mL所配制的草酸溶液置于锥形瓶内,加入适量稀硫酸。
③用浓度为a mol/L的KMnO4溶液滴定到终点。
所发生的反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O 。试回答:
(1)实验中不需要的仪器有___________(填序号),还缺少的玻璃仪器有________(填名称)。
a.托盘天平(带砝码,镊子) b.滴定管 c.100mL量筒 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)实验中,标准液KMnO4溶液应装在_____________式滴定管中。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会____________(填“偏大”、“ 偏小”、“ 无影响”)
(4)滴定时,根据_______________现象,即可确定反应达到终点。
(5)在滴定过程中若用amol/L的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为_______mol/L,由此可计算x的值是____________。
高二化学实验题中等难度题查看答案及解析
-
草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
①称取w g草酸晶体,配成100.00 mL水溶液。
②量取25.00 mL所配制的草酸溶液置于锥形瓶内,加入适量稀硫酸。
③用浓度为a mol·L-1的KMnO4溶液滴定至KMnO4不再褪色为止。
所发生的反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
试回答下列问题:
(1)下列仪器中,实验中不需要的有(填序号)__________,还缺少的仪器有(填名称)_______________。
a.托盘天平(带砝码,镊子) b.滴定管c.100 mL量筒 d.100 mL容量瓶 e.烧杯 f.漏斗g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)实验中,标准KMnO4溶液应装在________式滴定管中,因为_____________________。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会____(填“偏大”、“偏小”或“无影响”)。
(4)在滴定过程中若用a mol·L-1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为___mol·L-1,由此可计算x值是____。
高二化学实验题中等难度题查看答案及解析