-
有可逆反应Fe(s)+CO2(g)  FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是 (双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;
②再通入CO___________。
(5)该反应的逆反应速率随时间变化的关系如下图:
①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)__ __。(单选)
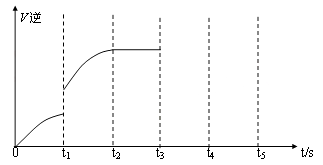
A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的V(逆)变化曲线
-
有可逆反应Fe(s)+CO2(g)  FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是 (双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了 C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_____________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式______________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=______________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度________________;②再通入CO_________________。
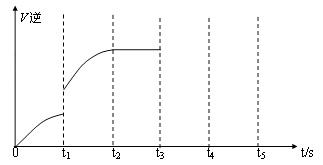
(5)该反应的逆反应速率随时间变化的关系如图:
①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)
__ ___。(单选)
A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线
-
有可逆反应Fe(s)+CO2(g) FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
(1)能判断该反应达到平衡状态的依据是 (填序号)。
A.容器内压强不变 B.c(CO)不变
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②再加入少量Fe___________。
-
有可逆反应Fe(s)+CO2(g) FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。则下列说法不正确的是
FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。则下列说法不正确的是
A. 该反应的平衡常数表达式为K=c(CO)/c(CO2)
B. 该反应的逆反应是放热反应
C. v正(CO2)=v逆(CO)时该反应达到平衡状态
D. c(CO2):c(CO)=1:1时该反应达到平衡状态
-
有可逆反应Fe(s)+CO2(g) FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
(1)能判断该反应达到平衡状态的依据是___(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0mol/L,则该温度下上述反应的平衡常数K=___(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。升高温度____;
-
有可逆反应Fe(s)+CO2(g) FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
(1)能判断该反应达到平衡状态的依据是____(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_____(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式____。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=____(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度______;②再通入CO______。
(5)该反应的逆反应速率随时间变化的关系如图:
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是(填序号)____。(单选)
A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线_______

-
有可逆反应Fe(s)+CO2(g)  FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是__________(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②加压___________。
-
有可逆反应Fe(s)+CO2(g)  FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是__________(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②再通入CO___________。
(5)该反应的逆反应速率随时间变化的关系如下图:

①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)___________。(单选)
A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线______________
-
有可逆反应Fe(s)+CO2(g) FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)1mol铁粉和1molCO2在2L密闭容器中反应,判断该反应达到平衡状态的依据是 (填序号)。
A.容器内压强不再改变
B.c(CO)不再改变
C.生成1mol的FeO
D.c(CO2)=c(CO)
E.v正(CO2)=v逆(C O)
O)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.4 mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K= (保留二位有效数字)。
(4)一定条件下,该反应在体积固定的密闭容器中进行一段时间后达到平衡状态。使该平衡状态正向移动的措施有(写出两条) 、 。
-
有可逆反应Fe(s)+CO2(g)  FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
(1)能判断该反应达到平衡状态的依据是 (双选,填序号)。
A.容器内压强不变了
B.C(CO)不变了
C.v正(CO2)=v逆(CO)
D.C(CO2):c(CO)=1:1
(2)该反应的逆反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。①升高温度__________;②再通入CO___________。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。



