-
甲醇是一种用途广泛的化工原料。
(1)工业上常用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g) ΔH1= -90.1KJ/mol
CH3OH(g) ΔH1= -90.1KJ/mol
②CO2(g)+ 3H2(g)  CH3OH(g) + H2O(l) ΔH2
CH3OH(g) + H2O(l) ΔH2
已知:CO(g)+ H2O (g) = CO2 (g) + H2 (g) ΔH3=-41.1 KJ/mol ③
H2O (l) =H2O (g) ΔH4=+44.0KJ/mol ④
则ΔH2=
(2)实验室模拟用CO和H2反应来制甲醇。在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol•L-1)变化如下表所示:(前6min没有改变条件)
| 2min | 4min | 6min | 8min | … |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
①x= 。
②250℃时该反应的平衡常数K值为: (不必化简)。
③若6min~8min只改变了某一条件,所改变的条件是 。
④第8min时,该反应是不是达到平衡状态 。(填“是”或“不是”)
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:Ⅰ.此温度下的催化剂活性高;Ⅱ. 。
(3)电解甲醇水溶液制氢的优点是需要的电压低,而且制得的氢气比电解相同物质的量的水多。写出电解甲醇水溶液的反应式为:阳极: 。
-
甲醇是一种重要的化工原料,有着重要的用途和应用前景。请回答下列问题:
(1)工业生产甲醇的常用方法是CO(g)+2H2(g) CH3OH(g) ΔH=-90.8 kJ·mol-1。
CH3OH(g) ΔH=-90.8 kJ·mol-1。
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;
H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1;
CH3OH(g)===CH3OH(l) ΔH=-37.3 kJ·mol-1。
计算液体CH3OH的燃烧热为 。
(2)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH 氧化为
氧化为
NO (2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO
(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO 反应转化为两种无毒气体。写出加入甲醇后反应的离子方程式: 。
反应转化为两种无毒气体。写出加入甲醇后反应的离子方程式: 。
(3)甲醇不完全燃烧产生的CO可利用I2O5来除去,其反应为5CO(g)+I2O5(s) 5CO2(g) +I2(s)。不
5CO2(g) +I2(s)。不
同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得的CO2体积分数随着时间
t变化曲线如图所示。则:
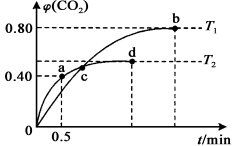
①T2温度时,0~0.5 min的反应速率v(CO)= 。
②T1温度时,反应达到平衡,CO的转化率为 ,化学平衡常数K= (用具体数值表示)。
③下列说法正确的是 (填编号)。
A.容器内压强不变,表明反应达到平衡状态
B.容器内气体密度不变,表明反应达到平衡状态
C.单位时间内,消耗a mol CO,同时消耗2a mol CO2, 表明反应v(正)<v(逆)
D.两种温度下,c点时体系中混合气体的压强相等
E.反应5CO(g)+I2O5(s) 5CO2(g)+I2(s)为吸热反应
5CO2(g)+I2(s)为吸热反应
(4)将500 mL(标准状况)甲醇不完全燃烧产生的气体样品通过盛有足量I2O5的干燥管,170 ℃下充分反应,用水—乙醇液充分溶解产物I2,定容到100 mL。取25.00 mL,用0.0100 mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00 mL,则样品气中CO的体积分数为 。(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)
-
(15分)甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:
2H2(g)+CO(g) CH3OH(g) ΔH=-90.8kJ/mol。
CH3OH(g) ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K= ,如升高温度,K值将 (填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是 .
A、混合气体的密度保持不变 B、甲醇的质量分数保持不变
C、CO的浓度保持不变 D、2v逆(H2)=v正(CH3OH)
(3)在2100C、2400C和2700C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
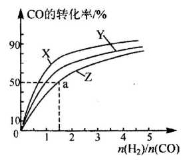
上图是上述三种温度下不同的H2和C0的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是 。由起始达到a点所需时间为5min,则H2的反应速率 mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
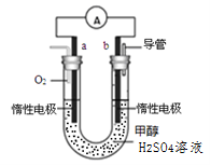
①该电池工作时,正极是 极(填“a”或 “b”);
②该电池负极反应的离子方程式为 。
-
(甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) 2H2(g)
2H2(g) CH3OH(g)
CH3OH(g) Q
Q
下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(1)判断反应达到平衡状态的依据是( )
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
(2)由表中数据判断Q________0 (填“>”、“ ”或“<”),要提高CO转化率,可采取的措施
”或“<”),要提高CO转化率,可采取的措施
是( )
A.加入催化剂 B.充入CO C.充入H2 D.升温
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v ________mol /(L·min),
________mol /(L·min),
CO的转化率为________。
(4)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s) CO2(g)
CO2(g)  2CO(g) 平衡常数K1
2CO(g) 平衡常数K1
C(s) H2O(g)
H2O(g)  CO(g)
CO(g) H2(g) 平衡常数K2
H2(g) 平衡常数K2
CO(g) H2O(g)
H2O(g)  H2(g)
H2(g) CO2(g) 平衡常数K3
CO2(g) 平衡常数K3
则K1、K2 、K3之间的关系是:________。
-
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用两种方法制备甲醇:
反应Ⅰ:CO(g) + 2H2 (g) CH3OH (g)
CH3OH (g)  H1
H1
反应Ⅱ:CO2(g) + 3H2(g) CH3OH (g)+H2O(g)
CH3OH (g)+H2O(g)  H2
H2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断H1_______________0(填“>”、“=”或“<”)。
②某温度下,将2molCO和6molH2充入2L密闭容器中充分反应,4分钟后反应达到平衡,测得CO的物质的量为0.4mol,则CO的反应速率为______________,此时的压强是反应前压强的___________倍。
(2)反应Ⅱ的平衡常数表达式为____________________,为了加快反应Ⅱ的反应速率,并且提高H2的转化率,采取的措施是_______________(填写正确选项的字母)。
a.增大CO2的浓度 b.增大H2的浓度
c.增大压强 d.加入催化剂
(3)工业上利用CO与水蒸气的反应,将有毒的CO转化为无毒的CO2,书写有关热化学反应方程式_______。该反应在830K下进行时,初始浓度到达平衡的时间有如下的关系:
| CO的初始浓度(mol/L) | 2 | 4 | 1 | 3 |
| H2的初始浓度(mol/L) | 3 | 2 | 3 | 3 |
| 时间(min) | 8 | 6 | 12 | n |
则n 为________min。
(4)近年来,科研人员新开发出一种甲醇和氧气以强碱溶液为电解质溶液的新型手机电池。该电池中甲醇发生反应的一极为______极、其电极反应式为_________________。
(5)用该电池作电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为 L。
-
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用两种方法制备甲醇:
反应Ⅰ:CO(g) + 2H2 (g)  CH3OH (g) DH1
CH3OH (g) DH1
反应Ⅱ:CO2(g) + 3H2(g)  CH3OH (g)+H2O(g) DH2
CH3OH (g)+H2O(g) DH2
① 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断DH1_______________0(填“<”、“=”或“>”)。
② 某温度下,将2molCO和6molH2充入2L密闭容器中充分反应,4分钟后反应达到平衡,测得CO的物质的量为0.4mol,则CO的反应速率为________________,此时的压强是反应前压强的___________倍。
(2)反应Ⅱ的平衡常数表达式为____________________,为了加快反应Ⅱ的反应速率,并且提高H2的转化率,采取的措施是_______________(填写正确选项的字母)。
a.增大CO2的浓度 b.增大H2的浓度
c.增大压强 d.加入催化剂
(3)工业上利用CO与水蒸气的反应,将有毒的CO转化为无毒的CO2,书写有关热化学反应方程式__________________________________。该反应在830K下进行时,初始浓度到达平衡的时间有如下的关系:
| CO的初始浓度(mol/L) | 2 | 4 | 1 | 3 |
| H2的初始浓度(mol/L) | 3 | 2 | 3 | 3 |
| 时间(min) | 8 | 6 | 12 | n |
则n 为________min。
(4)近年来,科研人员新开发出一种甲醇和氧气以强碱溶液为电解质溶液的新型手机电池。该电池中甲醇发生反应的一极为______极、其电极反应式为_________________。
(5)用该电池作电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为________L。
-
甲醇可采用多种方法制备,其用途广泛,是重要的化工原料。
Ⅰ.利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,发生反应如下:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
②CO2(g)+3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(1)反应①过程中能量变化如下图所示,下列说法正确的是______________(填选项标号)。
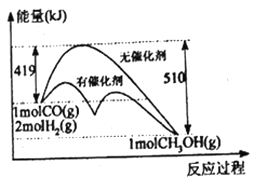
A.①反应的△H=逆反应活化能-正反应活化能
B.把1molCO(g)和2molH2(g)充入密闭容器中充分反应,达平衡时放出的热量为91kJ
C.从图中信息可知加入催化剂能改变反应历程和热效应
D.相同条件下,CO(g)和H2(g)反应生成1mol液态CH3OH放出的热量大于91kJ
(2) 现利用①和②两个反应合成CH3OH, 已知CO可使反应的催化剂寿命下降。
若氢碳比表示为f= [(n(H2)-n(CO2)]/[(n(CO)-n(CO2)],则理论上f=______________时,原料气的利用率最高。但生产中往往采用略高于该值的氢碳比,理由是:______________________________。
Ⅱ.甲醇可用于制取甲酸甲酯,其反应方程式为:CH3OH(g)+CO(g) HCOOCH3(g) △H<0。科研人员的部分研究结果如下:
HCOOCH3(g) △H<0。科研人员的部分研究结果如下:
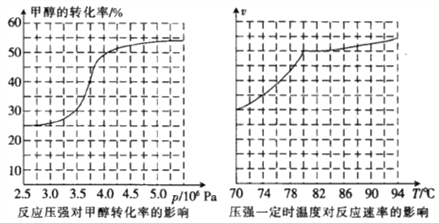
(3)从反应压强对甲醇转化率的影响“效率”图和生产成本角度分析,工业制取甲酸甲酯应选择的最佳压强是______________________(填“3.5×106 Pa”“4.0×106 Pa”或“5.0×106 Pa”)。
(4)实际工业生产中采用的温度是80℃,其理由是_______________________________________。
Ⅲ.甲醇还可以用于合成二甲醚,发生的反应为2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
己知该反应在某温度下的平衡常数为900,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol/L) | 1.25 | 0.9 | 0.9 |
(5)比较此时正、逆反应速率的大小: v正___________v逆 (填“>“<”或“=”)。
(6) 若加入CH3OH后,经6min反应达到平衡,则该时间内平均反应速率v (CH3OH) =___________mol/ (L·min)。
-
甲醇来源丰富,有广泛的用途和广阔的应用前景,工业上可以利用CO和CO2生产甲醇,同时可以利用甲醇生产丙烯。制备甲醇,丙烯过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.0kJ/mol
CH3OH(g) △H3=-90.0kJ/mol
反应Ⅳ:3CH3OH(g) C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
回答下列问题:
(1)反应Ⅱ的ΔH2=________。
(2)反应Ⅲ能够自发进行的条件是________(填“较低温度”“较高温度”或“任何温度”),据研究该反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于保持催化剂Cu2O的量不变,原因是________(用化学方程式表示)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2的生成速率与CH3OH的生成速率相等
D.容器的压强不再变化
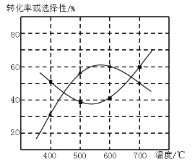
(4)甲醇生产丙烯的同时,还生成乙烯。在某催化剂作用下,2L密闭容器中加入0.5mol甲醇,经过相同时间后测得甲醇转化率及丙烯的选择性(生成丙烯的甲醇与甲醇转化量的比值)与反应温度之间的关系如图所示。计算600℃时反应甲醇生产丙烯的反应Ⅳ平衡常数________。若将容器体积压缩为1L,其他条件不变,在如图中作出甲醇平衡转化率随温度的变化曲线。________。
(5)研究表明,甲醇可由CO2在强酸性水溶液中通过电解合成,则生成甲醇的反应电极反应式:_______。
-
甲醇是21世纪应用最广泛的清洁燃料之一,通过下列反应可以制备甲醇:
CO (g) + 2H2 (g) CH3OH (l) △H
CH3OH (l) △H
(1)已知:
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H / kJ·mol-1 | -285.8 | -283.0 | -726.5 |
计算上述反应的△H= kJ·mol-1。
(2)在容积可变的密闭容器中充入1 mol CO ( g ) 和2 molH2 ( g )生成CH3OH( g ),H2的平衡转化率随温度(T)、压强(P)的变化如图所示。

① 该反应的△S 0,图中的T1 T2(填“<”、“>”或“=”)。
② 当达到平衡状态A 时,容器的体积为2 L,此时该反应的平衡常数为 ,若达到平衡状态B 时,则容器的体积V(B)= L。
③ 在该容器中,下列措施可增加甲醇产率的是 。
A.升高温度
B.从平衡体系中及时分离CH3OH
C.充入He
D.再充入0.5 mol CO和1 mol H2
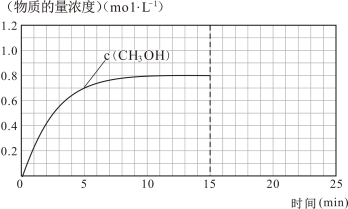
(3)在容积固定为2 L的密闭容器中充入2 molCO( g )和6 molH2( g )生成CH3OH( g ),反应时间与物质的量浓度的关系如下图所示,则前10分钟内,氢气的平均反应速率为 ;若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图中画出15-25分钟c (CO)的变化曲线。
-
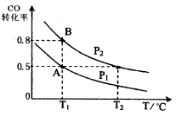
甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
(1)该反应的化学平衡常数表达式为 。
(2)如反应开始时仍充入10mol CO 和20mol H2,
则在平衡状态B时容器的体积V(B)= L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。
A.CO的含量保持不变
B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)
D.容器中混合气体的平均相对分子质量保持不变
(4)CO(g)+2H2(g) CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。
CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。
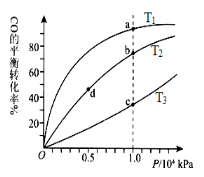
A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) =K(c) ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)已知CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由 CO2和H2制取甲醇的热化学方程式 。
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由 CO2和H2制取甲醇的热化学方程式 。
CH3OH(g) ΔH1= -90.1KJ/mol
CH3OH(g) + H2O(l) ΔH2









