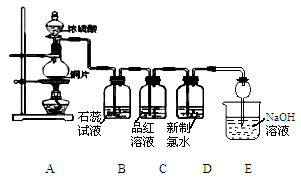-
(11分)某兴趣小组在研究性学习中设计了如下实验来探究Fe和H2SO4反应的过程,装置如下图所示。
①在烧瓶中加入浓硫酸。
②将提拉式铁丝插入溶液中,观察到有少量气泡,后停止的现象。
③加热烧瓶至有大量气体 产生时停止加热,品红溶液颜色褪去,烧瓶中溶液变为棕黄色。
④一段时间后KMnO4溶液颜色不再变浅,但NaOH 溶液中仍有气体放出,在导管口处可点燃此气体,烧瓶中液体变为浅绿色
根据以上实验回答:
由步骤②的现象可得出的结论是:
在步骤③中,品红溶液褪色的原因是
写出步骤④中,使溶液变为浅绿色的可能的原因是 (用离子方程式表示);
(4)KMnO4溶液褪色的化学方程式 。
(5)设计实验证明反应后的溶液中只有Fe2+ (答操作和现象)
(6)若在反应中铁丝质量减少a克,并收集到bL可燃性气体(标准状况下假设无体积损失),则在反应过程中产生的使品红溶液褪色的气体的质量是 (用含a、b数学表达式表示)
-
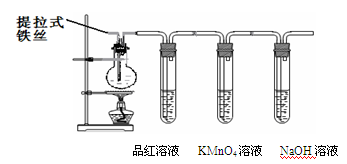
某兴趣小组在研究性学习中设计了如下实验来探究Fe和H2SO4反应的过程,装置如下图所示.
①在烧瓶中加入浓硫酸.
②将提拉式铁丝插入溶液中,观察到有少量气泡,后停止的现象.
③加热烧瓶至有大量气体产生时停止加热,品红溶液颜色褪去,烧瓶中溶液变为棕黄色.
④一段时间后KMnO4溶液颜色不再变浅,但NaOH 溶液中仍有气体放出,在导管口处可点燃此气体,烧瓶中液体变为浅绿色
根据以上实验回答:
(1)由步骤②的现象可得出的结论是:______
(2)在步骤③中,品红溶液褪色的原因是______
(3)写出步骤④中,使溶液变为浅绿色的可能的原因是(用离子方程式表示)____________
(4)若1g氢气燃烧生成液态水放出142.9KJ热量,则氢气的燃烧热的热化学方程式是:______
(5)若在反应中铁丝质量减少a克,并收集到bL可燃性气体(标准状况下假设无体积损失),则在反应过程中产生的使品红溶液褪色的气体的质量是______(用含a、b数学表达式表示)
-
(10分)某化学小组想探究铁与浓硫酸能否反应产生气体,进行了如下实验:
【实验】甲同学在烧瓶中加入足量的铁丝与浓H2SO4溶液,开始无明显变化,对反应物加热,有气泡产生可收集到无色气体。
【查阅资料】①铁与浓硫酸在常温下会发生钝化,看不到明显现象,加热情况下会反应,产生有刺激性气味的二氧化硫气体;
②二氧化硫气体能使品红溶液褪色,能被氢氧化钠溶液吸收。
【提出假设】甲同学认为收集到的就是二氧化硫气体,乙同学认为还有氢气,你认为乙同学预测有氢气的理由是:_________________________。
气体的组成可能有以下几种情况:
假设一:无色气体是SO2;
假设二:_________________________;
假设三:无色气体是SO2 与H2 的混合气体。
【实验验证】请你设计实验验证上述假设三,完成下表中内容。小组同学在实验室找到可能在实验探究过程中能用到的试剂有:品红溶液、NaOH溶液、火柴、CuO粉末、无水硫酸铜,仪器任选。
| 实验方案与步骤 | 实验现象和结论 |
| 1.将少量气体通入盛有少量品红溶液的试管内; | 若_____________________, 则无色气体中有SO2。 |
| 2.________________________________________________________________________________________________________________ | 若_______________________,则无色气体中有H2。 结合以上实验可知假设三成立。 |
-
某校研究性学习小组,探究一定量的浓硫酸与足量锌充分反应产生的气体产物,进行如下实验:按图组装好实验装置,在A中加入5 mL 98%的浓硫酸和足量的锌粒,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。

试回答:
(1)从装置A进入装置B中的气体可能有:______、_________、______。
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____、____接b,c接____、____接d;D、E两支试管中CCl4溶液的作用是_________________。
(3)能证明浓硫酸具有强氧化性的实验现象为__________________________;
(4)D中浑浊消失的离子反应方程式为_______________________________。
-
某校研究性学习小组,探究一定量的浓硫酸与足量锌充分反应产生的气体产物,进行如下实验:按图组装好实验装置,在A中加入5 mL 98%的浓硫酸和足量的锌粒,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。

试回答下列问题:
(1)写出A中从反应开始到停止可能发生反应的化学方程式:_________________________________________。
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____、____接b,c接____、____接d;D、E两支试管中CCl4的作用是_______________________________。
(3)能证明浓硫酸具有强氧化性的实验现象为___________________________________;反应较长时间后气泡量又会明显增加的原因是_________________________________。
(4)D中浑浊消失的离子反应方程式为_________________________________________。
-
为进行某些实验的探究,某兴趣小组设计了如下装置。
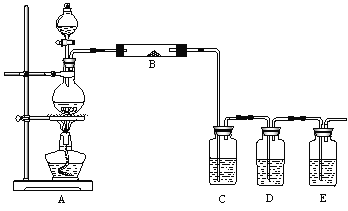
(1)为探究浓硫酸与木炭反应的全部产物,分液漏斗中盛浓硫酸,圆底烧瓶中放木炭。
①装置B中试剂的名称是________。
②装置C、D、E中所盛放的试剂分别是品红、酸性KMnO4溶液和澄清的石灰水。C装置的作用是________,确认产物中含有CO2的实验现象是________。
(2)为了制取无水氯化铜,上述装置中的分液漏斗中盛浓盐酸,圆底烧瓶中放MnO2,B中放铜粉并在玻璃管下添加酒精灯,且将B装置平移至D与E之间。
①此时C、D中依次加入的试剂分别是________。
②若E中为NaOH溶液用于尾气吸收,常温下发生反应的离子方程式为________。
③实验结束时,应首先熄灭装置B下面的酒精灯,其目的是________。
-
某化学兴趣小组为探究SO2的化学性质,设计了如下图所示的装置进行实验。回答下列问题:
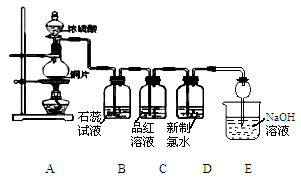
(1)装置A中盛放浓硫酸的仪器名称是________,写出圆底烧瓶发生反应的化学方程式________。
(2)E装置中干燥管的作用是____________________________。
(3)实验过程中,观察到B中的现象是_______________,原因是__________________;观察到C瓶中氯水褪色,这是因为SO2具有_______性,反应的离子方程式为__________________。
(4)用装置C还能探究SO2与品红作用的可逆性,请写出实验操作及现象__________________。
(5)充分反应后,小组同学发现铜和硫酸都有剩余,原因是___________________。若想使剩余的铜溶解,可再加入___________(填序号)。
①盐酸;②硝酸;③NaNO3固体;④K2SO4固体
-
某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色)
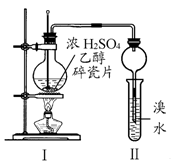
已知:装置Ⅰ中生成乙烯的化学方程式 为C2H5OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
(1)写出乙烯的电子式 。
(2)溶液“变棕黑”,说明浓硫酸具有 性。
(3)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 。
A.乙烯与溴水易发生取代反应
B.使溴水褪色的反应,不一定是加成反应
C.使溴水褪色的物质,不一定是乙烯
(4)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是 ,发生的反应方程式为 。
(5)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如图装置,则A中的试剂应为 ,B中的试剂为 。

(6)写出乙醇在铜催化下氧化的方程式 。
-
(13分)某化学兴趣小组为探索铜跟浓硫酸的反应,用下图所示装置进行有关实验。请回答:

I.实验中甲同学取a 克 Cu 片和12ml 18mol/L浓H2SO4放人圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
(1)请写出Cu与浓H2SO4反应的化学方程式:。
装置E中试管D内盛品红溶液,当C中气体集满后,D中有可能观察到的现象是__________。
实验装置D有可能造成环境污染,试用最简单方法加以解决(实验用品自选)_________。
(2)装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生进入B,B中应放置的液体(填字母):________
A.饱和Na2SO3溶液 B.酸性 KMnO4溶液
C.浓溴水 D.饱和NaHSO3溶液
(3)问题讨论:为什么有一定量的余酸但未能使Cu完全溶解呢?
足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是_________。
A.Fe粉 B.BaCl2溶液 C.Ag D.饱和NaHSO3溶液
(4)实验中甲学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是___________(填名称),反应方程式是______________。
-
某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出):
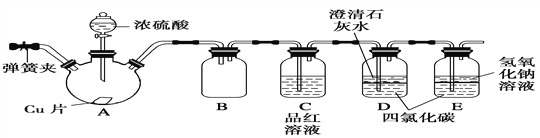
请回答下列问题:
(1)Cu与浓H2SO4的反应的化学方程式为____________________。
(2)D、E两容器中CCl4的作用是____________________。
(3)加热过程中,随着反应的进行,A容器下有白色沉淀生成,你认为该沉淀物是_________,分析可能的原因是________________________________________。
(4)对A容器中的浓H2SO4和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是_________________,设计实验验证你的猜想_______________________________________。
(5)实验结束后,为了减少环境污染,排除各装置中的SO2,可采取的操作是________________________________________________________。