-
金属铝用途广泛,工业上利用铝矾土矿(主要成分是Al2O3)制备金属铝。
(1)首先获得纯净的Al2O3,其工艺流程如下:

①滤液中通入过量CO2时主要反应的离子方程式是_______________________。
②煅烧生成氧化铝的化学方程式是 __________________________________。
(2)将Al2O3溶解于熔融的冰晶石(助熔剂)中,以碳素材料为阴极,石墨棒为阳极,进行电解。
①下列关于Al2O3的说法正确的是________________(填序号)。
a. Al2O3属于电解质
b. Al2O3属于离子化合物
c. Al2O3属于碱性氧化物
d. Al2O3的熔点低,可作耐火材料
②阳极石墨棒需要不断补充,写出电极反应式并简述其原因:________________。
(3)高纯度氧化铝也可利用铵明矾分解制得:
①铵明矾晶体的化学式为NH4Al(SO4)2•12H2O,铵明矾属于__(填“纯净物”或“混合物”),在0.1mol/L铵明矾的水溶液中,浓度最大的离子是______,c(NH4+ ) ____c(Al3+)(填“=”“>”或“<”);
②铵明矾分解反应:6NH4Al(SO4)2•12H2O 3Al2O3 + 2NH3 ↑+ 2N2 ↑+ 6SO2 ↑+ 6SO3 ↑+ 81H2O,请标出此反应电子转移的方向和数目______。
3Al2O3 + 2NH3 ↑+ 2N2 ↑+ 6SO2 ↑+ 6SO3 ↑+ 81H2O,请标出此反应电子转移的方向和数目______。
-
金属铝用途广泛,工业上利用铝矾土矿(主要成分是Al2O3)制备金属铝。
(1)首先获得纯净的Al2O3,其工艺流程如下:
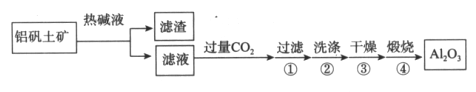
①滤液中通入过量CO2的反应离子方程式是________________。
②煅烧生成氧化铝的化学方程式是______________。
(2)将Al2O3溶解于熔融的冰晶石(助熔剂)中,以石墨衬里为阴极,石墨棒为阳极,进行电解。
①电解Al2O3能制备金属铝的原因是__________(填序号)。
a. Al2O3属于电解质
b. Al2O3属于离子化合物
c. Al2O3属于两性氧化物
d. Al2O3在熔融状态时能导电
②Al单质在_________极产生。
③阳极石墨棒需要不断补充,结合电极反应式,简述其原因是________________。
-
二氧化锗被广泛用于制作高纯金属锗、锗化合物、化工催化剂及医药工业,某工厂用褐煤烟灰(主要成分C、GeO2,还有少量Al2O3和SiO2)为原料制备GeO2,其流程如下:
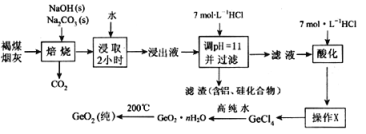
已知:GeO2难溶于水,不跟水反应,是以酸性为主的两性氧化物,溶于强碱溶液生成锗酸盐,与浓盐酸生成GeCl4(GeCl4的沸点是83.1℃)
(1)用水浸取焙烧物2小时的目的是____________________,操作“X”的名称为________,该操作除了冷凝管、铁架台、牛角管、锥形瓶、石棉网、酒精灯外还缺少的玻璃仪器是________
(2)写出焙烧时二氧化锗与氢氧化钠发生反应的化学方程式________________________________
(3)“酸化”至溶液中盐酸浓度为5.3 mol/L时有利于生成GeCl4,写出该反应的化学方程式:____若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,原因是____________
(4)GeO2产品中通常混有少量SiO2。取样品w g,测得其中氧原子的物质的量为n mol,则该样品中GeO2的物质的量为____________mol(用含w、n的代数式表示)
-
软锰矿的主要成分是MnO2,还含有少量(Hg2+等)重金属化合物杂质。黄铁矿的主要成分是FeS2,还含有SiO2和Al2O3等杂质。工业上采用同槽硫酸酸溶等工艺制备碳酸锰并回收硫酸铵,其主要流程如下:( 已知: Ksp[Al(OH) 3]=1 3×10-33,Ksp[Fe(OH) 3]=5.3×10-38,金属离子的浓度小于1×10-6视为沉淀完全。)
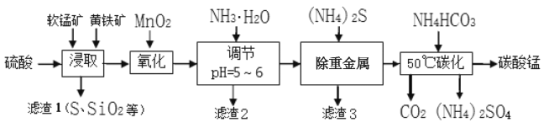
(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:
①适当升高温度,②搅拌,③_________________等。
(2)流程“氧化”中加入MnO2与Fe2+发生反应的离子方程式为_________________。
(3)“滤渣2”中主要成分的化学式为_________________。
(4)流程“除重金属”时使用(NH4)2S而不使用Na2S的原因是_________________。
(5)流程“50℃碳化”得到碳酸锰,该反应的化学方程式为_________________。
(6)生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是_________________。
-
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下: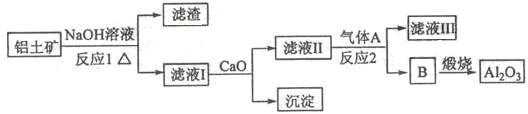
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下: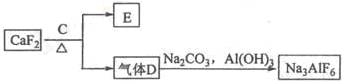
回答下列问题:
(1)写出反应1的化学方程式___________________________ ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为_______________ ;
(3)E可作为建筑材料,化合物C是_____ ,写出由D制备冰晶石的化学方程式 ____________;
(4)电解制铝的化学方程式是 _____________________________________,以石墨为电极,阳极产生的混合气体的成分是 _________________。
-
铝鞣剂在皮革工业有广泛应用。某学习小组以铝灰(主要成分是Al、A12O3、FeO、SiO2等)为原料制备铝鞣剂[Al(OH)2Cl],设计工艺流程如下图所示:
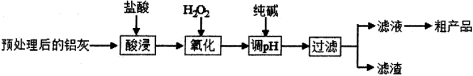
已知:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 2.8 |
| A13+ | 3.4 | 4.7 |
| Fe2+ | 5.8 | 8.8 |
请回答下列问题:
(1)酸浸时温度控制在30℃-35℃,不宜太低,也不宜太高,其原因是_________。
(2)氧化时的离子方程式为_________。
(3)调节溶液的pH范围为_________。
(4)滤渣中主要含有物质的化学式是_________。
-
某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O)。

请回答:
(1)步骤Ⅰ中,发生的氧化还原反应的离子方程式为___,涉及到的分离操作是___。
(2)试剂X是___;溶液D是___。
(3)溶液E在空气中易被氧化,请设计一个简单的实验方案检验溶液E是否被氧化___。
(4)在步骤Ⅱ时,若用大理石与浓盐酸制取CO2并直接通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是___。
(5)工业上常用溶液E制取净水剂Na2FeO4,流程如图:
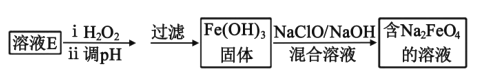
写出由Fe(OH)3制取Na2FeO4的离子方程式___。(已知NaClO还原为NaCl)
-
二氧化锗被广泛用于制作高纯金属锗、锗的化合物、化工催化剂及医药工业, 某工厂用褐煤烟灰(主要成分为C、GeO2,还有少量Al2O3和SiO2)为原料制备GeO2,其流程如 下:
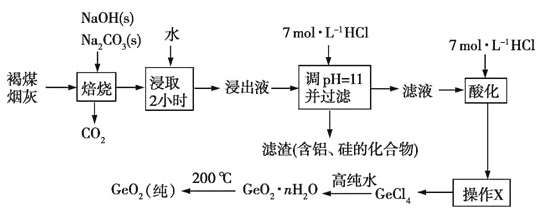
已知:GeO2不溶于水,不跟水反应,是以酸性为主的两性氧化物,可溶于浓盐酸生成四氯化锗,也可溶于强碱溶液,生成锗酸盐。操作X为蒸馏
(1)褐煤灰中加入NaOH和Na2CO3固体进行焙烧时,要加入过量的粉碎的NaOH和Na2CO3固体,其原因是_________________。写出GeO2与NaOH反应的化学方程式:__________。
(2)为提高含锗化合物的浸出率,除采用水浸取焙烧物2小时外,还可采取的措施有_____________。(写出两条即可)
(3)浸出液中滴加7mol/L盐酸,调节溶液的pH约为11,目的是__________。
(4)滴加7mol/L盐酸使滤液“酸化”,若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,该沉淀物是________________,(写化学式)
(5)GeCl4的沸点是83.1℃,其电子式为______________。
(6)单质锗可用作电子工业的半导体材料。由纯净的GeO2和H2在加热的条件下可制得单质锗.该反应的化学方程式为_________________。
-
实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:
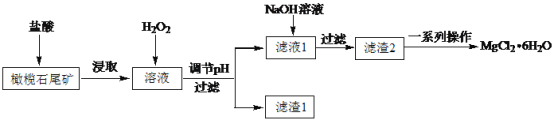
已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
| Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
| 沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有____(任写一种)。
(2)滤渣1为Fe(OH)3,则调节pH的范围为____。
(3)“一系列操作”主要包括加入足量盐酸,然后经过蒸发浓缩、冷却结晶、过滤、洗涤,即得到氯化镁晶体。加入足量盐酸的作用为①溶解滤渣2,②____。
(4)准确称取2.000 g氯化镁晶体产品于250 mL锥形瓶中,加50 mL蒸馏水使其完全溶解,在不断振荡下,调节pH并加入合适的指示剂,用0.5000 mol/L的EDTA(在方程式中用Y4−表示)标准溶液进行滴定,其反应原理为Mg2++Y4− = MgY2−,滴定达到终点时消耗EDTA标准溶液的体积为19.00 mL。
①计算产品中MgCl2·6H2O的质量分数。____(写出计算过程,结果保留三位有效数字)。
②下列滴定操作会导致测量结果偏高的是____(填字母)。
a.滴定终点时仰视读数
b.锥形瓶洗涤后没有干燥
c.滴定时锥形瓶中有液体溅出
d.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
-
碳酸锂广泛应用于陶瓷和医药等领域,以β—锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下:
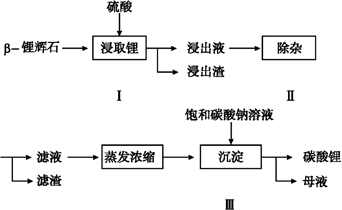
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2 g、12.7 g和1.3 g。
(1)步骤Ⅰ前,β—锂辉石要粉碎成细颗粒的目的是 。
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-;另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入 (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有 。
(4)步骤Ⅲ中,生成沉淀的离子方程式为 ________。
(5)从母液中可回收的主要物质是 ________。

3Al2O3 + 2NH3 ↑+ 2N2 ↑+ 6SO2 ↑+ 6SO3 ↑+ 81H2O,请标出此反应电子转移的方向和数目______。










