-
NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时才有I2析出。某课题组用0.02mol/LNaHSO3溶液和0.02mol/L KIO3溶液,以及淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式:__________________________。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
| 编号 | NaHSO3溶液(mL) | KIO3溶液(mL) | H2O(mL) | 反应温度(℃)/ | 变蓝时间(t/s) |
| ① | 10 | 15 | a | 10 | t1 |
| ② | 10 | 40 | 0 | 10 | t2 |
| ③ | 10 | b | 0 | 20 | t3 |
表中a=_________,b=_________。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。
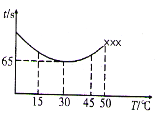
①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应速率为_______mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你描述低于50℃时,溶液变蓝所需时间与反应温度的关系:__________________。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组在排除浓度、温度等影响因素后,对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;I2浓度越大反应速率越快;
假设二:________________________________________________________;
假设三:________________________________________________________;
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
| 实验方案 | 预期实验现象和结论 |
| 第一步:在烧杯甲中将NaHSO3溶液与过量KIO3 溶液混合, 用测速仪测定起始时的反应速率V(甲) 第二步:在烧杯乙中________________________,测定其起始阶段的相同时间内的反应速率V(乙) | 若__________,则假 设一成立 |
-
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol/LNaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
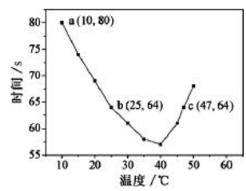
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0×10-5mol·L-1·s-1
D.温度高于40℃时,淀粉不宜用作该实验的指示剂
-
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、
KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如右图。据图分析,下列判断不正确的是

A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1
C.图中b、c两点对应的NaHSO3反应速率相等
D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂
-
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是( )

A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.当NaHSO3消耗时的离子方程式为:5HSO3-+2IO3-=5SO42-+I2+3H++H2O
C.图中a点对应的NaHSO3反应速率为5.5×10-5 mol·L-1·s-1
D.温度高于40℃时,淀粉不宜用作该实验的指示剂
-
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
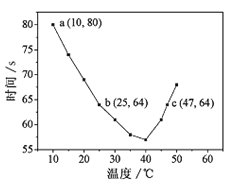
A. 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3反应速率相等
C. 图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
-
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1NaHSO3(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如右图。据图分析,下列判断不正确的是
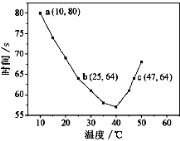
A .40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率不等
C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D.温度高于40℃时,淀粉适宜用作该试验的指示剂
-
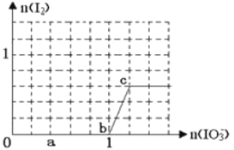
已知溶液中:氧化性IO3—>I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是( )

A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O
-
已知:还原性HSO3¯>I¯,氧化性IO3¯> I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
A. 0--b :3HSO3-+ IO3-= 3SO42-+ I-+ 3H+
B. a点时消耗NaHSO3的物质的量为1.2 mol
C. b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
D. 当溶液中I¯与I2的物质的量之比为5∶2时,加入的KIO3为1.8mol
-
已知:还原性HSO3->I-,氧化性IO3->I2。在含3mol NaHSO3的溶液中逐滴加人KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是

A. 0-a段发生反应:3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b段共消耗NaHSO3的物质的量为1.8mol
C. b~c段反应:氧化产物为I2
D. 当溶液中I-与I2的物质的量之比为5 : 1时,加入的KIO3为1.lmol
-
某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3 溶液,一段时间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料知:NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3-+3HSO3-==3SO42-+I-+3H+,则第二步反应的离子方程式为________________;
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
| 编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
实验①②是探究_______________对反应速率的影响,表中t1___________t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=_____________,b=_____________;
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的SO42—对反应起催化作用,故设计实验验证,试完成下表中内容。
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率υ(甲) 在烧杯乙中先加入少量①______,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率υ(乙) | ②若υ(甲)_______υ(乙),则假设不成立 ③若υ(甲)_______υ(乙),则假设成立 (填“>”、“=”或“<”) |








