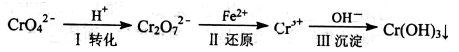-
环境中常见的重金属污染物有:汞、铅、锰、铬、镉。处理工业废水中含有的Cr2O72-和CrO42-,常用的方法为还原沉淀法,该法的工艺流程为CrO42-Cr2O72-Cr3+Cr(OH)3↓。
其中第①步存在平衡2CrO42- (黄色)+2H+ Cr2O72- (橙色)+H2O。
Cr2O72- (橙色)+H2O。
(1)写出第①步反应的平衡常数表达式 。
(2)关于第①步反应,下列说法正确的是 。
A.通过测定溶液的pH可以判断反应是否已达到平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol Cr2O72-,需要 mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为 。
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程): 。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程): 。
-
环境中常见的重金属污染物有:汞、铅、锰、铬、镉。处理工业废水中含有的Cr2O72-和CrO42-,常用的方法有两种。
方法1 还原沉淀法
该法的工艺流程为 。
。
其中第①步存在平衡2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O。
Cr2O72-(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol Cr2O72-,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):____________________________________________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):____________________________________________________________________________。
方法2 电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O72-的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是___________________________________________________________。
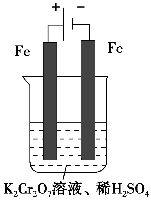
-
环境中常见的重金属污染物有:汞、铅、锰、铬、镉。处理工业废水中含有的Cr2O72—和CrO42—,常用的方法有两种。
方法1 还原沉淀法
该法的工艺流程为 。
。
其中第①步存在平衡2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O。
Cr2O72—(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_______________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol Cr2O72—,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):__________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):__________。
方法2 电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O72—的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是___________________。

-
(16分)环境中常见的重金属污染有:汞、铅、锰、铬、镉。处理工业废水中常含有的Cr2O2-7和CrO2-4离子,常用的方法有两种。
方法1:还原沉淀法
该法的工艺流程为:

其中第①步存在平衡:

(1)写出第①步反应的平衡常数表达式________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH值可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 molCr2O2-7离子,需要________mol的FeSO4·7H2O。
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为。在溶液中存在以下沉淀溶解平衡: 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
________
________
方法2:电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O2-7的废水,电解时阳极反应式为________,阴极区反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________。

-
铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水。
I、还原沉淀法是处理含Cr2O42— 和CrO72—工业废水的一种常用方法,其工艺流程如下:
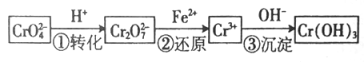
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72— (橙色)+H2O
Cr2O72— (橙色)+H2O
(1)若平衡体系中,pH=0时溶液显 色。
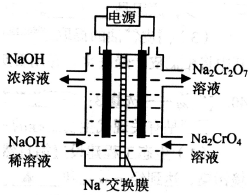
(2)以石墨为电极,电解Na2CrO4制备Na2Cr2O7的装置如图所示。
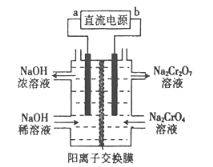
a极的名称是 ;b极直接相连一极的反应式为 。
(3)第②步反应的离子方程式: 。
第②步反应后的溶液加入一定量烧碱,若溶液中c(Fe3+)=2.0×10—12mol·L—1,则溶液中c(Cr3+)= mol·L—1。(已知Ksp[Fe(OH)3]=4.0×10—38 mol·L—1,Ksp[Cr(OH)3]=6.0x10—31 mol·L—1)。
II、探究CrO3的强氧化性和热稳定性
(4)CrO3遇有机物(如酒精)时猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。补充并配平下列反应式:
aCrO3+bC2H5OH+cH2SO4=dCr2(SO4)3+eCH3COOH+fR
b:c:f= 。
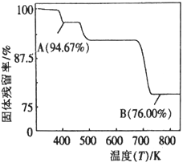
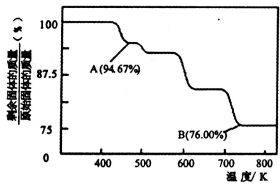
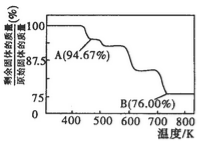
(5)CrO3的热稳定性差,加热时逐步分解,其固定残留率随温度的变化如图所示。B点时生成固体的化学式为 。(固体残留率=  )
)
-
(15分)铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。
(1)还原沉淀法是处理含Cr2O72— 和CrO42—工业废水的一种常用方法,其工艺流程为:
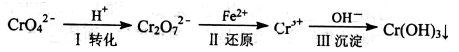
其中第I步存在平衡:2CrO42—(黄色)+2H+ Cr2O72— (橙色)+H2O
Cr2O72— (橙色)+H2O
①若平衡体系的pH=2,该溶液显 色。
②根据2CrO42—+2H+ Cr2O72— +H2O,设计下图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为 ,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72— +H2O,设计下图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为 ,图中右侧电极连接电源的 极,其电极反应式为 。
③第Ⅱ步反应的离子方程式: ,向Ⅱ反应后的溶液加一定量NaOH,若溶液中c(Fe3+)=2.0×10—12mol·L—1,则溶液中c(Cr3+)= mol·L—1。(已知Ksp[Fe(OH)3]=4.0×10—38,Ksp[Cr(OH)3]=6.0x10—31)。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。完成该反应的化学方程式:

(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。B点时剩余固体的成分是 (填化学式)。
-
铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。
(1)还原沉淀法是处理含Cr2O72-和CrO42-工业废水的一种常用方法,其工艺流程为:

其中第Ⅰ步存在平衡:2Cr2O42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
①若平衡体系的pH=0,该溶液显__________色。
②根据 2Cr2O42-(黄色)+2H+ Cr2O72-(橙色)+H2O设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为_________,图中右侧电极连接电源的_________极,其电极反应式为_________________。
Cr2O72-(橙色)+H2O设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为_________,图中右侧电极连接电源的_________极,其电极反应式为_________________。
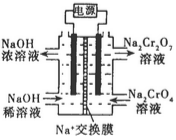
③第Ⅱ步反应的离子方程式:_________________________。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。完成该反应的化学方程式:

(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。B点时剩余固体的成分是____________(填化学式)。
-
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有以下两种:
方法1:还原沉淀法
该法的工艺流程为:
CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3
Cr(OH)3
其中第①步存在平衡2CrO42-(黄色)+2H+ Cr2O32-(橙色)+H2O
Cr2O32-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色。
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至______。
Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至______。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为______(用电极反应式解释)。
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______。
-
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显色_________。
(2)能说明第①步反应达平衡状态的是___________。
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要_________mol的FeSO4∙7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要c(Cr3+)降至10−5mol/L,溶液的pH应调至_________________。
Cr3+(aq)+3OH−(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要c(Cr3+)降至10−5mol/L,溶液的pH应调至_________________。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为____________。
(6)在阴极附近溶液pH升高的原因是__________(用电极反应解释),溶液中同时生成的沉淀还有_____________。
-
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.
方法1:还原沉淀法该法的工艺流程为:CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓其中第①步存在平衡:2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O
Cr(OH)3↓其中第①步存在平衡:2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是______.
a.Cr2O72-和CrO42-的浓度相同 b.2v(Cr2O72-)=v(CrO42-) c.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要______mol的FeSO4•7H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)═Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法,该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe做电极的原因为______.
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)______,溶液中同时生成的沉淀还有______.
。
Cr2O72-(橙色)+H2O。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):____________________________________________________________________________。

 。
。


 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)


 )
)