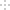-
草酸亚铁(FeC2O4·2H2O)可用于制备磷酸铁锂电池正极材料。实验室制备草酸亚铁并测定其组成的实验流程如下:
(1) “溶解”时加热的目的是_____________________;“沉铁”时将溶液煮沸并在不断搅拌下加入H2C2O4溶液,“不断搅拌”除可使反应物充分接触外,另一目的是_____________________。
(2) “过滤、洗涤”时,能说明沉淀已洗涤干净的依据是_____________________。
(3)按以下步骤可以测定产品中草酸根的质量分数。
①称取0.1600g草酸亚铁于锥形瓶中,加入25mL 2 mol·L-1的H2SO4溶液,加热至40~50℃,使样品溶解。
②用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液23.80mL。
[5C2O + 2MnO
+ 2MnO +16H+=10CO2↑+2Mn2++8H2O ;5Fe2++MnO
+16H+=10CO2↑+2Mn2++8H2O ;5Fe2++MnO +8H+=5Fe3++Mn2++4H2O]
+8H+=5Fe3++Mn2++4H2O]
③在②滴定后的溶液中加入足量Zn粉(2Fe3++Zn = 2Fe2++Zn2+)和5mL 2 mol·L-1 的H2SO4溶液,煮沸约10min。
④将滤液过滤至另一个锥形瓶中,用10mL 1 mol·L-1的H2SO4溶液洗涤锥形瓶,将全部Fe2+转移入锥形瓶中,再用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积8.00 mL。
(I)测得的产品中n(Fe ) ∶n(C2O
) ∶n(C2O ) _________1∶1(填“>” “=”或“<”)。
) _________1∶1(填“>” “=”或“<”)。
(II)请计算产品中C2O 的质量分数(写出计算过程)。______________
的质量分数(写出计算过程)。______________
-
草酸亚铁(FeC2O4·2H2O)可用于制备磷酸铁锂电池正极材料。实验室制备草酸亚铁并测定其组成的实验流程如下:

(1) “溶解”时加热的目的是_____________________;“沉铁”时将溶液煮沸并在不断搅拌下加入H2C2O4溶液,“不断搅拌”除可使反应物充分接触外,另一目的是_____________________。
(2) “过滤、洗涤”时,能说明沉淀已洗涤干净的依据是_____________________。
(3)按以下步骤可以测定产品中草酸根的质量分数。
①称取0.1600g草酸亚铁于锥形瓶中,加入25mL 2 mol·L-1的H2SO4溶液,加热至40~50℃,使样品溶解。
②用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液23.80mL。
[5C2O + 2MnO
+ 2MnO +16H+=10CO2↑+2Mn2++8H2O ;5Fe2++MnO
+16H+=10CO2↑+2Mn2++8H2O ;5Fe2++MnO +8H+=5Fe3++Mn2++4H2O]
+8H+=5Fe3++Mn2++4H2O]
③在②滴定后的溶液中加入足量Zn粉(2Fe3++Zn = 2Fe2++Zn2+)和5mL 2 mol·L-1 的H2SO4溶液,煮沸约10min。
④将滤液过滤至另一个锥形瓶中,用10mL 1 mol·L-1的H2SO4溶液洗涤锥形瓶,将全部Fe2+转移入锥形瓶中,再用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积8.00 mL。
(I)测得的产品中n(Fe ) ∶n(C2O
) ∶n(C2O ) _________1∶1(填“>” “=”或“<”)。
) _________1∶1(填“>” “=”或“<”)。
(II)请计算产品中C2O 的质量分数(写出计算过程)。______________
的质量分数(写出计算过程)。______________
-
草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。某草酸亚铁样品(不含结晶水)中含有少量草酸,现用滴定法测定该样品中FeC2O4的含量。实验方案如下:
①将0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol·L-1的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol·L-1的H2SO4溶液,煮沸5~8 min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.020 00 mol·L-1的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 mL。
试回答下列问题:
(1)高锰酸钾标准液用________滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为______________________________________________________。
(3)滴定过程中眼睛应注视__________________ ,滴定终点现象是 ___________________
(4)在步骤②中,下列操作会引起测定结果偏高的是_____________。
a 滴定管在盛装高锰酸钾前未润洗
b 滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
c 滴定前读数正确,滴定终点时俯视读数
d 滴定前尖嘴有气泡,滴定后气泡消失
(5)0.20 g样品中FeC2O4的质量分数为____。(保留3位有效数字,不考虑步骤②中的损耗)
-
草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如图:

(1)仪器a的名称是___。
(2)从绿色化学考虑,该套装置存在的明显缺陷是___。
(3)向盛有草酸亚铁晶体的试管中滴入硫酸酸化的KMnO4溶液,振荡,溶液变为棕黄色,同时有气体生成。已知反应中MnO 转化为无色的Mn2+,则该过程中被氧化的元素是___。若反应中消耗lmolFeC2O4·2H2O,则参加反应的n(KMnO4)=___。
转化为无色的Mn2+,则该过程中被氧化的元素是___。若反应中消耗lmolFeC2O4·2H2O,则参加反应的n(KMnO4)=___。
(4)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验试剂是___。
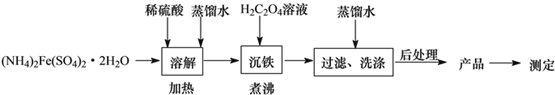
(5)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如图所示:
①图中M点对应物质的化学式为___。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出该化合物与稀盐酸反应的离子方程式:___。
-
磷酸亚铁[Fe3(PO4)2·8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇。主要用于制造磷酸铁锂电池。实验室制备磷酸亚铁的装置示意图、

反应和实验步骤如下。主要反应为:
3FeSO4+2Na2HPO4+2CH3COONa+8H2O=Fe3(PO4)2·8H2O↓+3Na2SO4+2CH3COOH
实验步骤:①在仪器A中先加入抗坏血酸(C6H8O6)稀溶液作底液②向仪器A中,滴入Na2HPO4与CH3COONa混合溶液至pH=4 ③滴入 15.2克FeSO4溶液,最终维持pH=6,充分反应后,静置④进行操作a,干燥得到的磷酸亚铁12.8克。
15.2克FeSO4溶液,最终维持pH=6,充分反应后,静置④进行操作a,干燥得到的磷酸亚铁12.8克。
(1)仪器A的名称是 。
(2)实验中配制FeSO4溶液时,先要对蒸馏水进行的操作是 。
(3)实验中不是将三种溶液直接混合的原因是 ,反应时需不断搅拌,其目的是 。
(4)步骤④进行的操作a是 。
(5)检验磷酸亚铁粗产品中是否混有氢氧化铁杂质的方法是 。
(6)本实验的产率是 。
-
磷酸铁(FePO4)为难溶于水的米白色固体,可用于制备药物、食品添加剂和锂离子电池的正极材料。实验室利用钛铁矿(主要成分为FeTiO3,含有少量MgO、CaO、SiO2等杂质)制备磷酸铁和锂离子电池正极材料(LiFePO4)的部分工业流程如图所示:
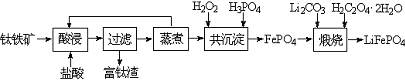
(1)富钛渣中的主要成分为TiO2和 (填化学式)。煅烧得到LiFePO4的化学方程式为 。
(2)在共沉淀步骤中加入H2O2的目的是让滤液中的Fe2+完全被H2O2氧化。
①反应的离子方程式为 。
②下列实验条件控制正确的是 (填序号)。
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行 D.用氨水调节pH=7
(3)已知Ca2+、Mg2+和Fe3+离子形成磷酸盐的Ksp分别为2.0×10-29、1.0×10-24和9.9×10-16,若溶液中三种金属阳离子的浓度均为0.1 mol·L-1,则加入H3PO4时首先生成沉淀的化学式为 。
(4)制备LiFePO4的过程中,理论上所需 17%双氧水与H2C2O4·2H2O的质量比为 。
(5)钛铁矿中钛含量的测定步骤为:
①还原。将含钛试样溶解于强酸溶液中,再加入铝片将TiO2+还原为Ti3+,并将Fe3+还原。反应装置如图所示,使用封闭漏斗的目的是 。
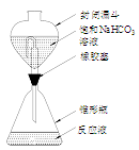
②滴定。取下封闭漏斗,向锥形瓶中加入2~3滴KSCN溶液,立即用FeCl3 标准溶液滴定至终点,记录读数。
③计算。下列操作会导致测定结果偏低的是 。
a.还原操作结束后铝片有剩余
b.还原操作结束后,反应液仍呈黄色
c.缓慢滴定,且剧烈振荡锥形瓶,但无溶液溅出
-
根据信息书写相关反应方程式:
(1)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。回收废旧磷酸亚铁锂电池正极片[含Al、炭黑、LiFePO4(难溶于水和碱)]中各物质的流程如下图所示:
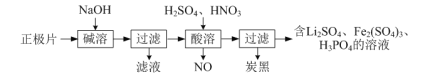
①写出“碱溶”时的离子方程式:________。
②写出“酸溶”时的化学方程式:________。
③LiFePO4可由Fe2O3、碳粉、LiH2PO4在480℃~900℃时混合共热制得,反应中还有CO生成,写出该反应的化学方程式:________。
(2)羟基自由基(电子式为 ,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
①pH=3时,Fe2+可循环催化H2O2的分解,过程中会产生·OH 中间体,转化过程如右图所示。写出转化Ⅱ的离子方程式:________。
②写出酸性条件下,·OH将水中的乙醛氧化成CO2和H2O的离子方程式:________。
-
某草酸亚铁样品中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:
5Fe2++5C2O42-+3MnO4-+24H+═5Fe3++10CO2↑+3Mn2++12H2O.
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b ml.
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后(不含Fe3+),继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c ml.
③______.
④数据处理.
请回答下列问题:
(1)上述实验方案中的步骤③是______.
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ.______;
Ⅱ.用高锰酸钾标准溶液润洗滴定管;
Ⅲ.加入高锰酸钾标准溶液,赶走尖嘴部位的气泡;
Ⅳ.______.
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有______溶液的试管中,如______,则说明溶液合格.
(4)某实验探究小组的一次测定数据记录如下:
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1582 | 0.00 | 29.90 | 40.90 |
| 0.1582 | 0.00 | 30.10 | 41.10 |
| 0.1582 | 0.00 | 32.10 | 43.10 |
根据数据计算0.1582g 样品中:n(Fe2+)=______; n(C2O42-)=______;FeC2O4(FeC2O4 的摩尔质量为144g/mol)的质量分数为______.(精确到0.1%)
-
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
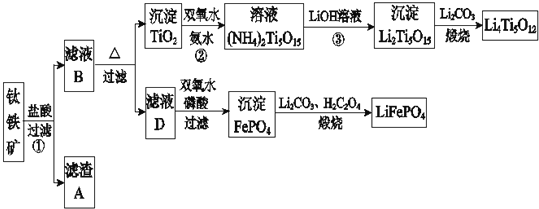
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O。
(1)化合物FeTiO3中铁元素的化合价是_______。
(2)滤渣A的成分是______________。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式是___________________。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如下图所示。反应温度过高时,Ti元素浸出率下降的原因是_______________。
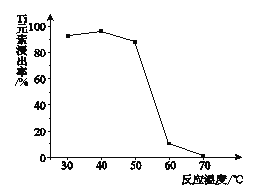
(5)反应③的化学方程式是__________________。
(6)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12+3LiFePO4 Li7Ti5O12+3FePO4。该电池充电时阳极反应式是_____________________。
Li7Ti5O12+3FePO4。该电池充电时阳极反应式是_____________________。
-
草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。

下列说法正确的是
A.若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B.实验时只需要在装置①中反应结束后再通入N2
C.若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D.实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁

+ 2MnO
+16H+=10CO2↑+2Mn2++8H2O ;5Fe2++MnO
+8H+=5Fe3++Mn2++4H2O]
) ∶n(C2O
) _________1∶1(填“>” “=”或“<”)。
的质量分数(写出计算过程)。______________