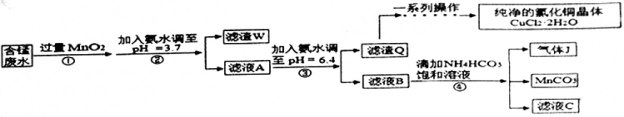-
高纯碳酸锰(MnCO3)广泛应用于电子行业,制造高性能磁性材料。工业利用含锰废水(主要含Mn2+、 、H+、Fe2+、Al3+、Cu2+)制备碳酸锰、回收硫酸铵的工艺流程如下:
、H+、Fe2+、Al3+、Cu2+)制备碳酸锰、回收硫酸铵的工艺流程如下:
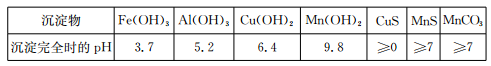
已知某些物质完全沉淀的pH值如表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的pH | 3.7 | 5.2 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
回答下列问题:
(1)试剂X是___________ (填标号)。
a.Cl2 b.MnO2 c.浓HNO3 d.H2O2
(2)“滤渣1”中主要成分的化学式为__________。
(3)“除重金属”时发生反应的离子方程式是______;反应中使用(NH4)2S而不使用Na2S的原因是________。
(4)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_____,反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4,加入稍过量的NH4HCO3的目的是______使MnCO3沉淀完全,溶液的pH不能过低的原因是_____。
(5)由 MnCO3可制得重要的催化剂MnO2,2MnCO3+O2=2MnO2+2CO2。现在空气中加热460.0g的MnCO3,得到332.0g产品,若产品中杂质只有MnO,则该产品MnO2的质量分数是___________。
-
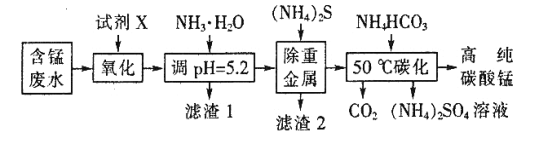
I.利用含锰废水(主要含Mn2+、SO 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
已知某些物质完全沉淀的pH如下表:
回答下列问题:
(1)过程②中,所得滤渣的主要成分是 。
(2)过程③中,发生反应的离子方程式是 。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是 。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2=2MnO2+2CO2。
现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是 (用百分数表示,小数点后保留1位)。
Ⅱ.常温下,浓度均为0.1 mol/L的下列六种溶液的pH如下表:
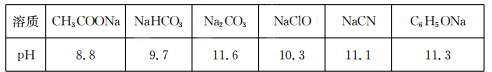
(1)上述盐溶液中的阴离子,结合H+能力最强的是 。
(2)根据表中数据判断,浓度均为0.0l mol/L的下列物质的溶液中,酸性最强的是
(填序号)。
A.HCN B.HC1O C.C6H5OH D.CH3 COOH E.H2 CO3
(3)据上表数据,请你判断下列反应不能成立的是 (填序号)。
A.HCN+ Na2 CO3=NaHCO3+NaCN
B.CH3 COOH+NaCN=CH3 COONa+HCN
C.CO2 +H2O+2C6 H5ONa=Na2 CO3 +2C6 H5OH
D.CH3 COONa+HClO=NaClO十CH3 COOH
-
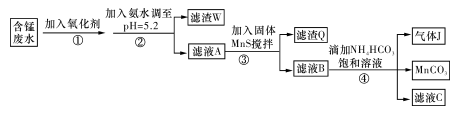
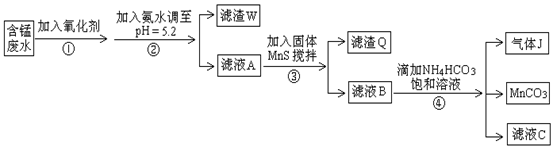
利用含锰废水(主要含Mn2+、SO42-、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
已知某些物质完全沉淀的pH值如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的PH | 3.7 | 5.2 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
回答下列问题:
(1)若下列物质均能把Fe2+氧化为Fe3+,则过程①中可选择加入的氧化剂是________。
a.Cl2 b.MnO2 c.浓HNO3 d.H2O2
(2)过程②中,所得滤渣的成分是________。
(3)过程③中,搅拌的目的是________,发生反应的离子方程式是________。
(4)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3反应的离子方程式是___________。
(5)由MnCO3可制得重要的催化剂MnO2,MnCO3 + O2 → MnO2 + CO2。
O2 → MnO2 + CO2。
现在空气中加热 460.0 g的MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是________。(摩尔质量/g·:MnCO3 115 MnO2 87 MnO 71)
-
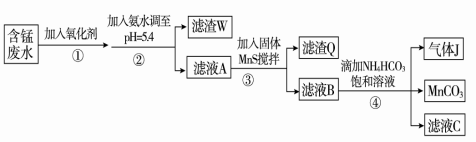
Ⅰ.利用含锰废水(主要含Mn2+、SO42-、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:
已知某些物质完全沉淀的pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的pH | 3.2 | 5.4 | 6.4 | 9.8[ | ≥0 | ≥7 | ≥7 |
回答 下列问题:
下列问题:
(1)过程②中,所得滤渣W的主要成分是 。
(2)过程③中,发生反应的离子方程式是 。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程
式是 。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2=2MnO2+2CO2。现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是 (用百分数表示,小数点后保留1位小数)。
Ⅱ.常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是 。
(2)根据表中数据判断,浓度均为0.01 mol·L-1的下列物质的溶液中,酸性最强的是 (填序号)。
A.HCN
B.HClO
C.C6H5OH
D. CH3COOH
CH3COOH
E.H2CO3
(3)根据上表数据,请你判断下列反应不能成立的是 (填序号)。
A.HCN+Na2CO3=NaHCO3+ NaCN
NaCN
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
D.CH3COONa+HClO=NaClO+CH3COOH
-
化学反应原理在化工生产和实验中有着广泛而重要的应用。
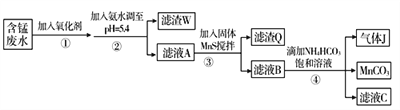
Ⅰ.利用含锰废水(主要含Mn2+、SO 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:
已知某些物质完全沉淀的pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的pH | 3.2 | 5.4 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
回答下列问题:
(1)过程②中,所得滤渣W的主要成分是______________________。
(2)过程③中,发生反应的离子方程式是______________________。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是_______________________。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2===2MnO2+2CO2。现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是________(用百分数表示,小数点后保留1位小数)。
Ⅱ.常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是_______________________。
(2)根据表中数据判断,浓度均为0.01 mol·L-1的下列物质的溶液中,酸性最强的是________(填序号)。
A. HCN B. HClO C. C6H5OH D. CH3COOH E. H2CO3
Ⅲ.已知:CO(g)+H2O(g) CO2(g)+H2(g) ΔH = Q kJ·mol-1其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH = Q kJ·mol-1其平衡常数随温度变化如下表所示:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___,该反应的Q____(填“>”或“<”)0。
(2)850 ℃时,向体积为10 L的反应器中通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)的浓度变化如图所示,则0~4 min时平均反应速率v(CO)=____。
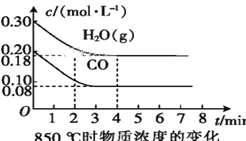
(3)若在500 ℃时进行上述反应,且CO、H2O(g)的起始浓度均为0.020 mol·L-1,该条件下,CO的最大转化率为____。
(4)若在850 ℃时进行上述反应,设起始时CO和H2O(g)共为1 mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的关系式:____。
-
利用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)可制备高性能磁性材料(MnCO3)及纯净的氯化铜晶体(CuCl2•2H2O)。工业流程如下:
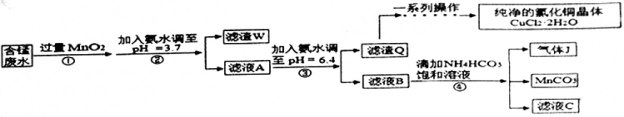
已知:几种金属离子沉淀的pH如表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
回答下列问题:
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为
(2)过程②中,所得滤渣W的成分是 。
(3)过程③中,调pH=6.4目的是 。
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是 。
(5)将滤渣Q溶解在过量的盐酸中,经过 ,过滤、洗涤、低温烘干,即可获得纯净的氯化铜晶体(CuCl2•2H2O)。
(6)过程④中,298K、c(Mn2+)为1.05mol/L时,实验测得MnCO3的产率与溶液pH、反应时间关系如右图。

据图中信息,你选择的最佳pH是 ;理由是 。
(7)从滤液C可得到的副产品是 (填化学式)。
-
以硫酸法钛白粉生产中排放的含锰废水(主要金属离子为Mn2+、Fe2+、Al3+,还含有少量Ca2+、Mg2+、Cu2+和Ni2+等离子)为原料,生产MnCO3的工艺流程如下:
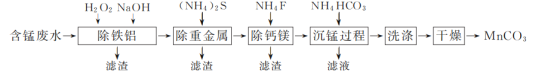
已知:25 ℃时,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11。
(1)流程中含锰废水经过前三步预处理,得到主要含有Mn2+的母液。
①除铁铝时,在搅拌条件下先加入H2O2溶液,再加入NaOH溶液调节pH。加入H2O2溶液时发生反应的离子方程式为__________________________________________。
②除钙镁步骤中,当Ca2+、Mg2+沉淀完全时,溶液中 =________。
=________。
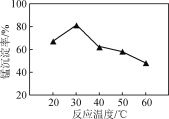
(2) 沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。
①沉锰过程发生反应的离子方程式为____________。该过程中加入适当过量的NH4HCO3的原因是________。
②当温度超过30 ℃,沉锰反应的锰沉淀率随温度升高而下降的原因是______________________________。
(3) 沉锰后过滤得到MnCO3粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的MnCO3。用无水乙醇洗涤的目的是____________________________。
-
碳酸锰(MnCO3) 是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1) 工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3 ↓+ (NH4)2SO4+CO2 ↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4。加入稍过量的NH4HCO3的目的是_____。
(2) 实验室模拟工业二氧化锰制备硫酸锰装置如图4所示。
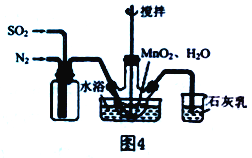
①石灰乳的作用是________。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有________。
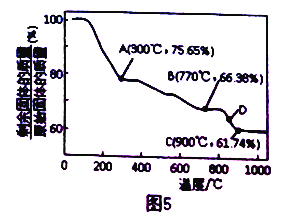
(3) MnCO3 在空气中加热易转化为不同价态的锰的氧化物,且其固体残留率随温度的变化如图5 中A、B、C、D 点所示。则300℃时,剩余固体中锰元素与氧元素的物质的量之比即n(Mn) :n(O)为_______; 图中点D 对应固体的成分为______ (填化学式)。
-
碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1)工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是 。
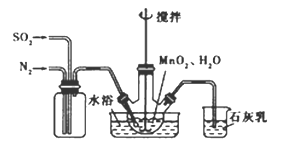
(2)实验室模拟工业二氧化锰制备硫酸锰装置如图
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
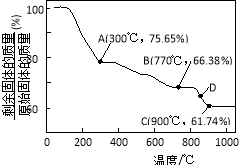
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
-
碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业.一种制备MnCO3的生产流程如图所示.
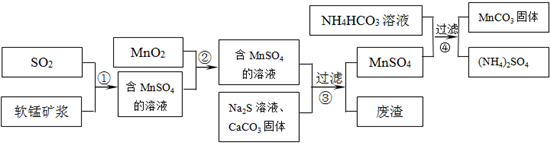
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
| 物质 | MnS | CuS | PbS |
| Ksp | 2.5×10-13 | 6.3×10-36 | 8.0×10-28 |
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气.流程①中主要发生的反应有:MnO2+SO2=MnSO4 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH______(填“大”或“小”),该流程可与______(填工业生产名称)联合,生产效益更高.
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为______,这样设计的目的和原理是______
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是______.
(4)反应④发生的化学反应为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是______,溶液的pH不能过低的原因是______.
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是______.(答对1个即可)
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下: