-
氨在工农业生产中应用广泛。在压强为30 MPa时,合成氨平衡混合气体中NH3的体积分数如下:
| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是__________________________________________________。
(2)根据下图,合成氨的热化学方程式是__________________________。
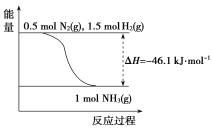
(3)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量________92.2 kJ(填“大于”“等于”或“小于”),原因是________________________;若加入催化剂,ΔH________(填“变大”“变小”或“不变”)。
(4)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(5)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为____________________。
-
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下表.请回答:
| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是______________________________________.
(2)在一定温度下,将2molN2和6 molH2通入到体积为1 L的密闭容器中,发生反应N2+ 3H2 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=_________;该温度下的平衡常数K=___________(用分数表示);欲使K增大,可以采取的措施是_______.
2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=_________;该温度下的平衡常数K=___________(用分数表示);欲使K增大,可以采取的措施是_______.
(3)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是____(选填序号字母);从化学反应速率的角度分析,提高反应速率可采取的措施是_____(选填序号字母).
a.及时分离出NH3 b.升高温度 c.增大压强 d.使用催化剂
-
某一温度下将1mol N2和4mol H2导入一体积为2L的密闭容器中,测得容器内压强为40Mpa,当20min后,反应达到平衡,测得NH3在混合气体里占25%(体积含量).求:(1)N2的平衡转化率; (2)H2的平均反应速率; (3)平衡时容器内的压强.
-
压强对合成氨反应具有重要的影响。下表是反应达到平衡时压强与NH3含量的一些实验数据:
| 压强/MPa | 10 | 20 | 30 | 60 | 100 |
| NH3含量(体积分数)/% | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
从表中数据可以推断:随着压强增大,平衡时NH3含量
A.增加 B.减少 C.先增加,后减 D.先减少,后增加
-
总压强为3.0×107Pa时,N2、H2混合气体(体积之比为1:3)通入合成塔中,反应达平衡时,压强降为2.5×107Pa,则平衡时混合气体中NH3的体积分数为( )
A. 35% B. 30% C. 25% D. 20%
-
氮及其化合物在工农业生产、生活中有着重要作用。完成下列填空:
合成氨工业中:N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1________ K2(填写“>”、“=”或“<”)
(2)400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数的值为_____________。当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,则该反应υ(N2)(正)___________υ(N2)(逆)(填写“>”、“=”或“<”)
N2(g)+3H2(g)的化学平衡常数的值为_____________。当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,则该反应υ(N2)(正)___________υ(N2)(逆)(填写“>”、“=”或“<”)
(3)在密闭恒容的容器中,下列能作为合成氨反应达到平衡的依据的是____________。
a.υ(N2)(正)=3υ(H2)(逆)b.混合气体的密度保持不变
c.容器内压强保持不变d.N2、H2、NH3的浓度之比为1∶3∶2
(4)化工生产为做到又“快”又“多”采用多种方法,试写出两项合成氨工业中为实现“多”所采取的措施:__________________________,__________________________。
(5)0.1mol/L的(NH4)2SO4水溶液中各离子浓度由大到小的顺序是_____________________,在该溶液中加入少量明矾固体,溶液中 的浓度_______(填“增大”、“减小”或“不变”),其原因是___________________。
的浓度_______(填“增大”、“减小”或“不变”),其原因是___________________。
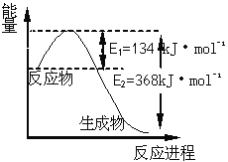
(6)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_____________________________________________。
-
合成氨工业发生反应:N2 + 3H2  2NH3 ,下列措施不属于加快反应速率的是
2NH3 ,下列措施不属于加快反应速率的是
A. 温度控制在500℃ B. 铁触媒作为催化剂
C. 压强控制在20MPa ~ 50MPa D. 混合气体中分离出液态氨
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是________。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
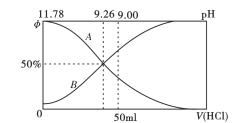
①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
③当加入盐酸体积为50ml时,溶被中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是______。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100m10.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
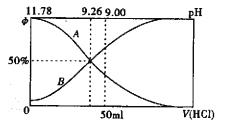
①表示NH3·H2O浓度变化的曲线是______(填“ A”或“B")。
②NH3·H2O 的电离常数为_______(已知1g1.8=0.26)
③当加入盐酸体积为50ml 时,溶液中c(NH4+)-c(NH3·H2O)=____mol/L (用精确值表示)。
II.已知常温下,Ksp[Al(OH)3]=4.0×10-38,在AlCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:________________;若将所得悬浊液的pH 调整为3,则溶液中Al3+浓度为_____mol/L。
-
在1905年,德国人哈伯发明了工业合成氨技术,其反应方程式是N2(g)+3H2(g) 2NH3(g) △H<0。下图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。下列说法正确的是
2NH3(g) △H<0。下图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。下列说法正确的是
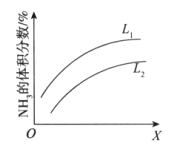
A. L代表的是压强,且L1>L2
B. L代表的是压强,且L1<L2
C. L代表的是温度,且L1<L2
D. L代表的是温度,且L1>L2




