-
室温下,某一元弱酸HA的电离常数K=1.6×10-6。 向20.00 mL 浓度约为0.1 mol·L-1 HA溶液中逐滴加入0.1000 mol·L-1 的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:(已知lg4=0.6)
(1)a点溶液中pH约为________,此时溶液中H2O电离出的c(H+)为________。
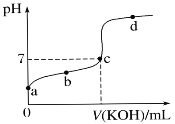
(2)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用__________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(3)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_________________(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(4)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_____mol/L。
| 实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
| 1 | 21.01 | 20.00 |
| 2 | 20.99 | 20.00 |
| 3 | 21.60 | 20.00 |
-
室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
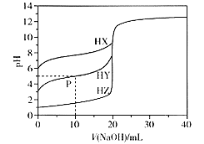
A.电离常数Ka(HX)的数量级为10-12
B.P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
C.pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D.HX的电离程度大于X-的水解程度
-
(8分)20℃时,醋酸的电离平衡常数为1.6×10-5。
(1)试计算20℃时0.01mol•L-1的醋酸溶液中氢离子浓度。
(2)室温时,向0.2mol•L-1的醋酸溶液中加入等体积的0.1mol•L-1的NaOH(aq),充分反应后所得溶液的PH=4,则:
①所得溶液中各离子(包括CH3COOH分子)浓度大小关系是:______________________,
②所得溶液中的物料守恒式为:________+________=__________=_________mol•L-1。
③c(CH3COOH)=_____________mol•L-1(写出算式,不做近似计算)
-
(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH= ,此酸的电离平衡常数K= ,由HA电离出的H+的浓度约为水电离出的H+的浓度的 倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶剂。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发生反应的离子方程式是 。
②现将0.04mol﹒L-1HA溶液和0.02mol﹒L-1NaOH溶液等体积混合,得到缓冲溶液。
a、若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”)。
b、若HA为CH3COOH,该溶液显酸性,溶液中所有的离子按浓度由大到小排列的顺序是 。
-
常温下,向20.00mL0.1mol·L-1KOH溶液中滴加0.1 mol·L -1HA(弱酸)溶液,混合溶液中水电离出的c(OH-)与HA溶液体积之间的关系如图I所示:向20.00mL0.1 mol ·L-1 HA溶液中滴加0. 1mol ·L-1 KOH溶液,混合溶液中水电离出的c(OH-)与KOH溶液体积之间的关系如图II所示。
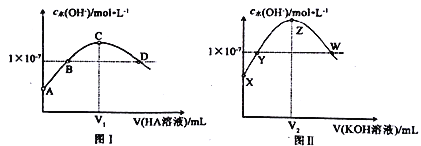
下列有关说法正确的是
A.A点、X点对应溶液中水的电离程度相同
B.B点、Y点对应溶液的pH相等
C.C点、Z点对应溶液中都存在:c(OH-)=c(H+)+c(HA)
D.D点、W点对应溶液中分别都存在:c(K+)=c(A-)
-
已知某温度下,四种一元弱酸的电离平衡常数为:

物质的量浓度都为0.1 mol.L-1的下列溶液中,pH最小的是( )
A.HCN B.CH3COOH C.HF D.HNO2
-
室温下,用相同浓度的NaOH 溶液,分别滴定100mL浓度均为0.1mol·L-1 的三种酸(HM、HN和HR) 溶液,滴定的曲线如图所示,下列判断错误的是( )
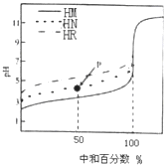
A. 三种酸的电离常数关系: KHR>KHN>KHM
B. pH=7时,三种溶液中:c (M-) >c (N-)>c (R-)
C. 滴定至P点时,溶液中:c (Na+) >c (N-) >c (HN) >c (H+) >c (OH-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR) =c(OH-)-c(H+)
-
下表是常温下某些一元弱酸的电离常数:
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-4 |
物质的量浓度均为0.1 mol·L-1的下列溶液中,pH由大到小的顺序是
A.HCN>HNO2>CH3COOH>HF B.HF>HNO2>CH3COOH>HCN
C.HCN>CH3COOH>HNO2>HF D.HCN>CH3COOH>HF>HNO2
-
部分弱酸的电离平衡常数如表:
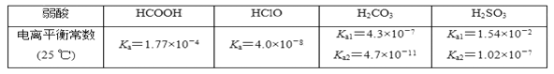
(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1
NaHCO3溶液的pH由大到小的关系为_____________________________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO 、CO
、CO 、HSO
、HSO 、HCO
、HCO 浓度由大到小的顺序为___________________________________。
浓度由大到小的顺序为___________________________________。
(3)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2===2HClO+CO b.2HCOOH+CO
b.2HCOOH+CO ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-===2HCOOH+SO d.Cl2+H2O+2CO
d.Cl2+H2O+2CO ===2HCO
===2HCO +Cl-+ClO-
+Cl-+ClO-
(4)某温度(T ℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示.
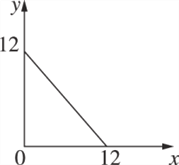
① 此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_____。
②在此温度下,0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 |
| 0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1 mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显________(填“酸”“碱”或“中”)性.写出按乙方式混合后,反应的离子方程式:__________________________。按甲方式混合后,所得溶液的pH为________。
-
25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液
(1)实验测得0.1 mol·L-1一元弱酸HA 的pH为4,则HA的电离平衡常数Ka= ;
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为 ;
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为 ;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是 ;
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)






