-
部分弱酸的电离平衡常数如表:
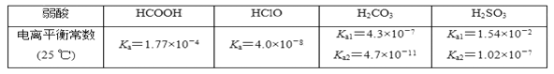
(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1
NaHCO3溶液的pH由大到小的关系为_____________________________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO 、CO
、CO 、HSO
、HSO 、HCO
、HCO 浓度由大到小的顺序为___________________________________。
浓度由大到小的顺序为___________________________________。
(3)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2===2HClO+CO b.2HCOOH+CO
b.2HCOOH+CO ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-===2HCOOH+SO d.Cl2+H2O+2CO
d.Cl2+H2O+2CO ===2HCO
===2HCO +Cl-+ClO-
+Cl-+ClO-
(4)某温度(T ℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示.
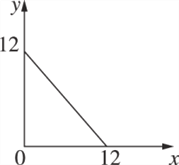
① 此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_____。
②在此温度下,0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 | 乙 | 丙 | 丁 |
| 0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1 mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显________(填“酸”“碱”或“中”)性.写出按乙方式混合后,反应的离子方程式:__________________________。按甲方式混合后,所得溶液的pH为________。
-
I.下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):

请回答下面问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是_____
A.c(H+) B.c(H+)·c(OH-) C. 
(2)CH3COONH4的水溶液呈_______ (选填 酸性”、“中性"或“碱性”)。
(3)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显酸性,通过计算说明其原因______。
(4)工业中常用碳酸镍制备氧化镍。已知:Ksp(NiCO3)=1.4×10-7,当 Ni,2+恰好完全转化为NiCO3沉淀[即溶液中c(Ni2+)=1×10-5 mol·L-1]时,溶液中c(CO32-)=_____mol/L。
II.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g) CH3CH2OH (g)+3H2O(g) △H=a kJ/mol
CH3CH2OH (g)+3H2O(g) △H=a kJ/mol
在一定压强下,测得.上述反应的实验数据如下表。
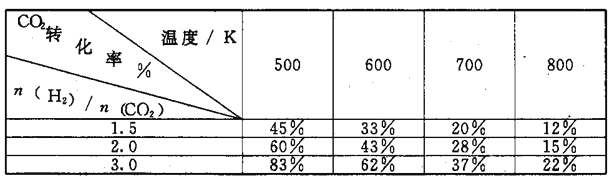
根据表中数据分析:
①上述反应的a_____0(填"大于”或“小于”)。
②在一定温度下.提高氢碳[即 ]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示;

根据上图,写出反应的热化学方程式为____________。
-
25℃时蚁酸HCOOH的电离平衡常数K=2×10-4,碳酸的电离平衡常数Ka1 =2 ×10-7、Ka2=2×10-11;请回答下列问题:
(1)写出0.1 mol·L-1HCOONa的水解方程式___________ ,并对溶液中的离子浓度从大到小排序 ___________。
(2)25℃时蚁酸与碳酸钠反应生成碳酸氢钠,计算反应平衡常数___________。依据计算结果判断该反应进行的完全程度___________(填“正反应完全”“逆反应完全”或“不完全”)。
(3)废水中的蚁酸根可以通过电解的方法除去变成与环境友好的物质,写出其电极反应___________ 。该电极材料选用___________ (填字母)。
A.石墨 B.锌 C.铜 D.银
-
部分弱酸的电离平衡常数如下表:
(1)室温下



 溶液的pH由大到小的关系为______.
溶液的pH由大到小的关系为______.
(2)浓度均为 的
的 和
和 的混合溶液中,
的混合溶液中,  、
、 、
、 、
、 浓度从大到小的顺序为______.
浓度从大到小的顺序为______.
(3)少量 通入到过量的NaClO溶液中发生反应的离子方程式______.
通入到过量的NaClO溶液中发生反应的离子方程式______.
(4)常温下,  的HCOOH溶液与
的HCOOH溶液与 的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为______.
的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为______.
-
室温下,某一元弱酸HA的电离常数K=1.6×10-6。 向20.00 mL 浓度约为0.1 mol·L-1 HA溶液中逐滴加入0.1000 mol·L-1 的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:(已知lg4=0.6)
(1)a点溶液中pH约为________,此时溶液中H2O电离出的c(H+)为________。
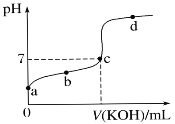
(2)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用__________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(3)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_________________(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(4)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_____mol/L。
| 实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
| 1 | 21.01 | 20.00 |
| 2 | 20.99 | 20.00 |
| 3 | 21.60 | 20.00 |
-
25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液
(1)实验测得0.1 mol·L-1一元弱酸HA 的pH为4,则HA的电离平衡常数Ka= ;
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为 ;
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为 ;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是 ;
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
-
25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液
(1)实验测得0.1 mol·L-1一元弱酸HA 的pH为4,则HA的电离平衡常数Ka= ;
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为 ;
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为 ;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是 ;
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
-
25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液。
(1)则0.1 mol·L-1一元弱酸HA的电离平衡常数表达式Ka=______________。
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为____________。
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为_________;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是__________。
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
(5)实验室在配制溶液时,一些物质存在水解的情况,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式__________,为了防止Al2(SO4)3发生水解,可加入少量的__________.
(6)已知25 ℃,碳酸的电离平衡常数Ka1= 4.0×10-7,Ka2= 5.6×10-11,则该温度下NaHCO3的水解平衡常数Kh=_____________。
-
已知部分弱酸的电离平衡常数如下表:

下列离子方程式正确的是( )
A. 少量CO2通入NaClO溶液中:CO2 + H2O + 2ClO-===CO32-+ 2HClO
B. 少量的SO2通入Ca(ClO)2溶液中:SO2 + H2O + Ca2+ + 2ClO-===CaSO3↓+2HClO
C. 少量的SO2通入Na2CO3溶液中:SO2 + H2O + 2CO32-===SO32-+ 2HCO3-
D. 相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H+ + HCO3-===CO2↑+ H2O
-
已知部分弱酸的电离平衡常数如下表:

下列离子方程式正确的是 ( )
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=HCO3-+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO32-=SO32-+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O

、CO
、HSO
、HCO
浓度由大到小的顺序为___________________________________。
b.2HCOOH+CO
===2HCOO-+H2O+CO2↑
d.Cl2+H2O+2CO
===2HCO
+Cl-+ClO-




 ]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。


