-
从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是_____(填序号)。
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)在现代半导体工业生产中,常利用 FeCl3 腐蚀铜的原理制作印刷线路板,写出该原理的离子方程式_______
(3)实验室在配制 FeSO4 溶液时为了防止 FeSO4 溶液变质,经常向其中加入铁粉,其原因是____________(用离子方程式表示) 。
(4)现有配制所得的 100mL 6mol/L FeSO4 溶液,往其中滴入一定量的稀硝酸,请回答下列问题:
①配平该反应的离子方程式:□Fe2++□NO3-+□H+ = □Fe3++□NO↑+□H2O_______
②要检验该反应后的溶液中是否含有 Fe3+,可选用的试剂为___________(从下列选项中选择)
A.酸性 KMnO4 溶液 B.KSCN 溶液 C.Cl2
③要检验该反应后的溶液中是否还含有 Fe2+,具体实验方案(含操作、现象、结论):_________
(5)已知Cl2和Fe3+都具有氧化性,如何设计实验证明氧化性Cl2强于Fe3+具体实验方案(含操作、现象、结论):__________。
高一化学解答题中等难度题查看答案及解析
-
从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是_____。
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)在现代半导体工业生产中,常利用 FeCl3 腐蚀铜的原理制作印刷线路板,写出该原理的化学方程式_____________
(3)实验室在配制 FeSO4 溶液时为了防止 FeSO4 溶液变质,经常向其中加入铁粉,其原因是______________(用离子方程式表示) 。
(4)现有配制所得的 100mL 6mol/L FeSO4 溶液,往其中滴入一定量的稀硝酸,请回答下列问题:
①配平该反应的离子方程式:□Fe2++□NO3-+□H+ = □Fe3++□NO↑+□H2O__________
②要检验该反应后的溶液中是否还含有 Fe2+,可选用的试剂为___________
A. 酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):____________________。
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)____________________L。
高一化学填空题中等难度题查看答案及解析
-
从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是_________________。
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)在现代化工生产中,常利用FeCl3腐蚀铜的原理制作印刷线路板,写出该原理的化学方程式_________________________________。
(3)实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是_____________________ (用离子方程式表示)。
(4)某同学甲取2 mL FeSO4溶液,加入1滴KSCN溶液,再加入几滴氯水,溶液变红,说明Cl2可将Fe2+氧化。绿矾溶液与氯水反应的离子方程式为_______。
(5)同学乙认为甲同学的实验不够严谨,该同学在2 mL FeSO4 溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是_____________。
(6)为测定某绿矾FeSO4·xH2O中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g;将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g;按下图连接好装置进行实验:
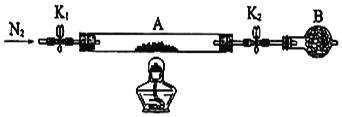
①仪器B的名称是____________。
②将下列实验操作步骤正确排序__________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却至室温
③根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水数目x=_______________________(列式表示)。
高一化学实验题中等难度题查看答案及解析
-
从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是________。
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)在现代工业生产中,常利用 FeCl3 腐蚀铜的原理制作印刷线路板,写出该原理的化学方程式_________________________
(3)实验室在配制 FeSO4 溶液时为了防止 FeSO4 溶液变质,经常向其中加入铁粉,其原因是_______________(用离子方程式表示) 。
(4)现有配制所得的 100mL 6mol/L FeSO4 溶液,往其中滴入一定量的稀硝酸,回答下列问题:
①配平该反应的离子方程式:□Fe2++□NO3-+□H+ = □Fe3++□NO↑+□H2O___________
②要检验该反应后的溶液中是否还含有 Fe2+,可选用的试剂为___________
A. 酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)_____________L。
高一化学综合题中等难度题查看答案及解析
-
从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)中国四大发明之一的指南针由天然磁石制成的,其主要成分是___。
A .Fe B.FeO C.Fe3O4 D.Fe2O3
(2)实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是___(用离子方程式表示)。
(3)某同学甲取2mLFeSO4溶液,加入1滴KSCN溶液,再加入几滴氯水,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为___。
(4)同学乙认为甲同学的实验不够严谨,该同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是___。
(5)为测定某绿矾FeSO4.xH2O中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。

①仪器B的名称是___。
②将下列实验操作步骤正确排序___(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水数目x=___(列式表示)。
高一化学实验题中等难度题查看答案及解析
-
铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题。
(1)中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是____________。
(2)在配置含有FeCl2溶液时,常常向溶液中加入少量铁粉,其原因是___________________。
(3)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是______,对应的化学方程式为_________。
(4)工业上常用FeCl3溶液做铜电路板的刻蚀液,反应的离子方程式是________________________。若向FeCl3溶液中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是____________
A.有铜剩余,溶液中阳离子仅含Fe2+ B.无固体剩余,溶液中阳离子含Fe2+和Cu2+
C.有铜剩余,溶液中阳离子含Fe3+和Cu2+ D.只有铁剩余,溶液中阳离子含Fe2+和Cu2+
(5)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+: _______________________________________。
高一化学综合题中等难度题查看答案及解析
-
中华民族的发明创造为人类文明进步做出了巨大贡献。下列我国古代发明中,不涉及化学反应的是( )
A.铜的冶炼 B.粮食酿醋
C.打磨磁石制指南针 D.火药的发明与使用
高一化学单选题中等难度题查看答案及解析
-
中华民族的发明创造为人类文明进步做出了巨大贡献。下列我国古代发明中,不涉及化学反应的是
A.铜的冶炼
B.打磨磁石制指南针
C.粮食酿醋
D.火药的发明与使用




A. A B. B C. C D. D
高一化学单选题简单题查看答案及解析
-
从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)实验室在配制 FeSO4溶液时为了防止 FeSO4溶液变质,经常向其中加入铁粉,其原因是______________(用离子方程式表示)。
(2)向FeSO4溶液中滴加氨水的现象为 ______________________,请用化学用语解释出现此现象的原因___________________;_____________________
(3)现有配制所得的 100mL 6mol/L FeSO4溶液,往其中滴入一定量稀硝酸,请回答下列问题:
①配平该反应的离子方程式:____Fe2+____NO3-+____H+ = ___Fe3++____NO↑+_____H2O(在横线上写上化学计量数)
②要检验该反应后的溶液中是否还含有 Fe2+,可选用下列的一种试剂为_______
A.酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):____________________。
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)____________________L。
高一化学填空题中等难度题查看答案及解析
-
化学与生活密切相关,下列说法错误的是
A. 用粘土焙烧制得的红陶,陶器显红色的原因可能是含有Fe2O3
B. 制指南针的磁石主要成分是四氧化三铁
C. 碳酸钠可以制成抗酸药,服用时喝些醋能提高药效
D. K-Na合金可作核反应堆的导热剂;Mg-Al合金可用于制造飞机部件
高一化学单选题中等难度题查看答案及解析