-
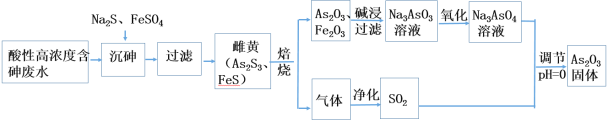
工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3.工艺流程如下:
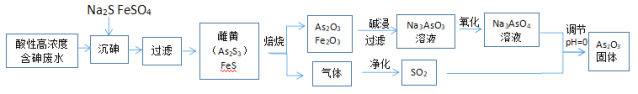 回答下列问题:
回答下列问题:
(1)“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS33- ;“沉砷”中FeSO4的作用是_____。
2AsS33- ;“沉砷”中FeSO4的作用是_____。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是___________。(写名称)
(4)“氧化”过程中,可以用单质碘为氧化剂进行氧化,写出该反应的离子方程式__________。
(5)调节pH=0时,请写出由Na3AsO4制备As2O3的离子方程式_________________。
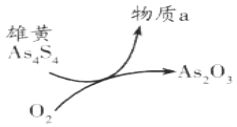
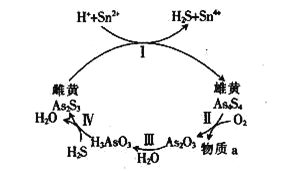
(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)
-
目前中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病。工业上利用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取As2O3的工艺流程如下:
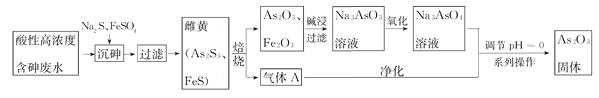
已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS32-
2AsS32-
回答下列问题:
(1)H3AsO3是一种两性偏酸性的化合物,As元素的化合价为_____________。
(2)“沉砷”中FeSO4的作用是________________________。
(3)“焙烧”过程产生的气体A的化学式为____________,检验该气体常用试剂为___________。
(4)调节pH=0时,发现酸性越强,As2O3的产率越高。可能的原因是__________________。获得As2O3固体,系列操作是________、______、_______。
(5)残留废渣中少量砒霜(As2O3)可以用双氧水氧化成H3AsO4而除去,该反应的化学方程式为:__________________________________。
-
工业上采用化学沉降法处理酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在),同时从沉渣中还可以提取出常用的中药药剂As2O3,基本实现了废水处理过程的“三废”零排放。工艺流如下:
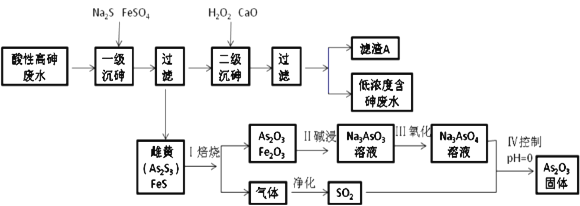
回答下列问题:
(1)H3AsO3中,砷元素的化合价为__________
(2)H3AsO3是三元弱酸,第一步和第二步电离是通过和水中的OH-结合实现的,第三步则直接电离出H+,第一步电离方程式为H3AsO3+H2O [As(OH)4]-+H+,则第二步电离方程式为________________________________。
[As(OH)4]-+H+,则第二步电离方程式为________________________________。
(3)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)  2AsS33-(aq); “一级沉砷”中FeSO4的作用是___________________________________________________
2AsS33-(aq); “一级沉砷”中FeSO4的作用是___________________________________________________
(4)“二级沉砷”后,滤渣A的主要成分,除含有Ca3(AsO4)2 、FeAsO4、Fe(OH)3外,还有________(写化学式)。
(5)写出Ⅳ过程中,由Na3AsO4制备As2O3 的离子方程式 ____________________________ 。
(6)砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 , K2=1.7×10-7 , K3=4.0×10-12, Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O HAsO42-+OH-,该步水解的平衡常数(25℃)为__________(保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为__________(保留两位有效数字)。
(7)雌黄(As2S3)和雄黄(As4S4 )是自然界中常见的砷化物,一定条件下,两者的转化关系如下图所示。若反应Ⅱ中,1mol As4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为_________。
-
工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3。工艺流程如下:

回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为________,“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)  2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是_________________________________。(写名称)
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为:_______________。
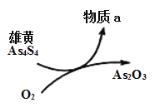
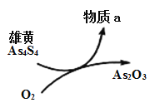
(5)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)

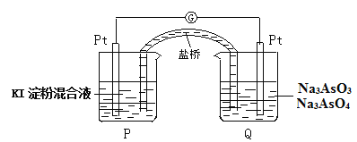
(6)某原电池装置如图,电池总反应为:AsO43-+2I-+H2O AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
-
工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3。工艺流程如下:
回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为________,“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)  2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是_________________________________。(写名称)
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为:_______________。
(5)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)
(6)某原电池装置如图,电池总反应为:AsO43-+2I-+H2O AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
-
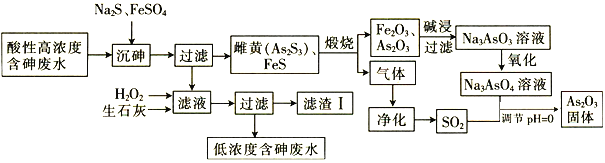
As2O3在玻璃工业中常用作澄清剂和脱色剂,工业上采用酸性高浓度含砷废水(主要以H3AsO3形式存在)提取As2O3的工艺流程如下:
回答下列问题:
(1)上述流程的_____过程中由于条件的原因,造成生成物中混有Fe3O4,为证明Fe3O4的存在,可利用Fe3O4具有_______性的这一物理性质。
(2)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为________。
(3)常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示:

①H3AsO3为_______元_______(填“强”或“弱”)酸。
②pH由7调节至10的过程中发生反应的离子方程式为__________。
③H3AsO3的一级电离平衡常数Ka1=__________。
(4)滤渣Ⅰ中含有FeAsO4、Fe(OH)3、Ca3(AsO4)2和 _______(填化学式);已知Ksp[FeAsO4]=5.7×10-21 ,含砷污染物允许排放标准为不大于0.5 mg∙L-1。若低浓度含砷废水(假设砷均以Na3AsO4形式存在)中Fe3+的浓度为1. 0×10-4 mol∙L-1 ,则低浓度含砷废水中Na3AsO4的浓度为_____ mg∙L-1,_____(填“符合”或“不符合”)排放标准。
-
工业上采用酸性高浓度含砷废水(砷主要以亚砷酸HAsO2形式存在,还含有少量Fe3+等杂质)提取重要化工原料As2O3。工艺流程如下:
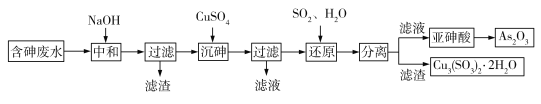
(1)“中和”时调节废水的pH为6,NaOH的作用是_____。
(2)“沉砷”时生成的沉淀是Cu(AsO2)2,发生反应的离子方程式是_____;此时使用了过量的CuSO4,原因是_____;沉砷时需控制体系的pH略显碱性,测得Cu(AsO2)2产物中铜元素含量较高,原因是_____。
(3)“还原”时发生反应的化学方程式是_____。
(4)下图表示其他条件不变下“还原”时,反应温度对砷浸出率和铜浸出率的影响(浸出率表示溶液中所要提取的元素被浸出的程度,即元素被浸出的百分率):
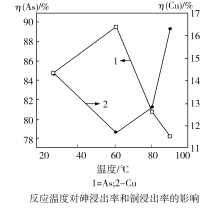
为达到铜砷分离尽量彻底的目的,应选择的最佳温度是_____。
-
工业上采用硫化钠-石灰铁盐法处理高砷废水(砷的主要存在形式为H3AsO3)取得了很好的效果.实现了废水处理过程的“三废”零排放.其主要工艺流程如下:
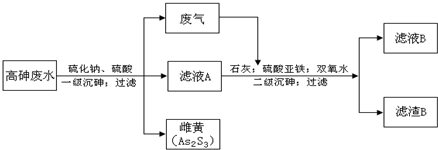
已知:①亚砷酸(H3AsO3)还原性较强,易被氧化为砷酸(H3AsO4)
②亚砷酸盐的溶解性大于相应的砷酸盐[如Ksp(FeAsO3)>Ksp(FeAsO4)]
请回答以下问题:
(1)废气的主要成分为______,通过与石灰发生______反应(填基本反应类型)被吸收.
(2)写出一级沉砷过程中生成雌黄的离子方程式:______.
(3)滤液A中,除了有Na2SO4、H2SO4以外,还有溶质______.
(4)二级沉砷过程中使用双氧水的目的有______.
A.将三价砷氧化为五价砷,以提高除砷效果
B.将Fe2+氧化可生成Fe(OH) 3沉淀,以加速悬浮物的沉降
C.作绿色氧化剂,不引进新的杂质
(5)过滤操作常用的玻璃仪器有:______
(6)滤渣B的主要成分有______(写两种,用化学式表示).
-
砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
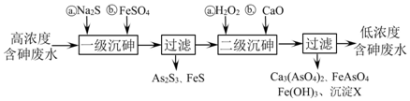
已知:①As2S3与过量的S2−存在以下反应:As2S3(s)+3S2−(aq) 2
2 (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为_______________________。
(2)“一级沉砷”中FeSO4的作用是_____________________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______________________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10−6 g)。
步骤1:取10 g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1 g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________。
(5)步骤2的离子方程式为___________________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10−5 g·kg−1,请通过计算说明该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准,原因是_________________________。
-
砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
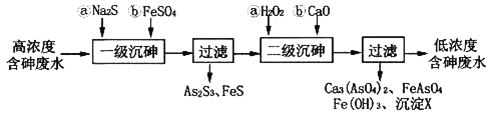
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)  2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为________________________。
(2)“一级沉砷”中FeSO4的作用是___________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为______________________________________________________________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________.
(5)步骤2的离子方程式为______________________________________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,则该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准.
 回答下列问题:
回答下列问题:2AsS33- ;“沉砷”中FeSO4的作用是_____。
















