-
连二亚硫酸钠(Na2S2O4)俗称保险粉,是工业上重要的还原性漂白剂,也是重要的食品抗氧化剂。某学习小组模拟工业流程设计实验制取保险粉。
已知:Na2S2O4是白色固体,还原性比Na2SO3强,易与酸反应(2S2O42-+4H+=3SO2↑+S↓+2H2O)。
(一)锌粉法
步骤1:按如图方式,温度控制在40~45℃,当三颈瓶中溶液pH在3~3.5时,停止通入SO2,反应后得到ZnS2O4溶液。
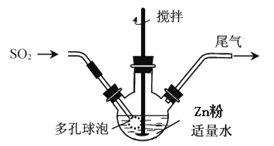
步骤2:将得到的ZnS2O4溶液加入NaOH溶液中,过滤,滤渣为Zn(OH)2,向滤液中加入一定量食盐,立即析出Na2S2O4•2H2O晶体。
步骤3:,经过滤,用乙醇洗涤,用120~140℃的热风干燥得到Na2S2O4。
(二)甲酸钠法
步骤4:按上图方式,将装置中的Zn粉和水换成HCOONa、Na2CO3溶液和乙醇。温度控制在70~83℃,持续通入SO2,维持溶液pH在4~6,经5~8小时充分反应后迅速降温45~55℃,立即析出无水Na2S2O4。
步骤5:经过滤,用乙醇洗涤,干燥得到Na2S2O4。
回答下列问题:
(1)步骤1容器中发生反应的化学方程式是______;容器中多孔球泡的作用是______。
(2)步骤2中“向滤液中加入一定量食盐,立即析出Na2S2O4•2H2O晶体”的原理是(用必要的化学用语和文字说明)______。
(3)两种方法中控制温度的加热方式是______。
(4)根据上述实验过程判断,Na2S2O4在水、乙醇中的溶解性为:______。
(5)甲酸钠法中生成Na2S2O4的总反应为______。
(6)两种方法相比较,锌粉法产品纯度高,可能的原因是______。
(7)限用以下给出的试剂,设计实验证明甲酸钠法制得的产品中含有Na2SO4。
稀盐酸、稀硫酸、稀硝酸、AgNO3溶液、BaCl2溶液______。
-
Na2S2O4俗称保险粉,常用做纺织工业的漂白剂、脱色剂等。某科研小组制备并探究其性质。
资料:Na2S2O4易溶于水,具有极强的还原性,易被空气氧化,在碱性介质中稳定。
Ⅰ.制备Na2S2O4 (部分加热等辅助仪器略去)
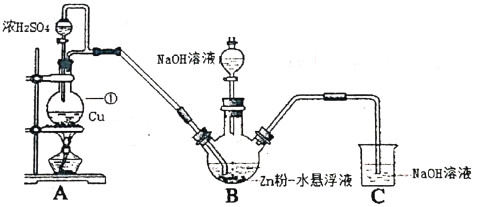
(1)仪器①的名称是___________。
(2)B装置用于制备Na2S2O4。第一步反应:Zn+2SO2 ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为___________。
ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为___________。
(3)实验时,先向B中通入SO2的原因,除产生Zn S2O4之外,另一原因是___________。
(4)反应后除去B中的沉淀,在滤液中加入一定量的NaCl固体搅拌,有Na2S2O4晶体析出。加入NaCl固体的作用是___________
Ⅱ.探究Na2S2O4的性质
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是___________。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4,溶液)
(6)制备纳米级银粉用NaOH溶液溶解Na2S2O4,加入一定量的AgNO3溶液,生成纳米级的银粉。在制备银粉的反应中,氧化剂和还原剂的物质的量之比为2:1,且生成的含硫物质只有一种,写出该反应的离子方程式___________。
(7)为测定某含硫代硫酸钠样品的纯度(其它杂质均不参加反应)设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品mg,配制成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加入少量淀粉溶液,用 nmol·L-1I2标准溶液滴定(发生反应:2S2O32-+I2=S4O32-+2I-),至滴定终点。
③滴定终点的现象为___________,平均消耗I2标准溶液VmL,样品中Na2S2O4的纯度为___________(用代数式表示)。
-
Na2S2O4俗称保险粉,常用做纺织工业的漂白剂、脱色剂等。某科研小组制备并探究其性质。
资料:Na2S2O4易溶于水,具有极强的还原性,易被空气氧化,在碱性介质中稳定。
Ⅰ.制备Na2S2O4(加热等辅助仪器略去)
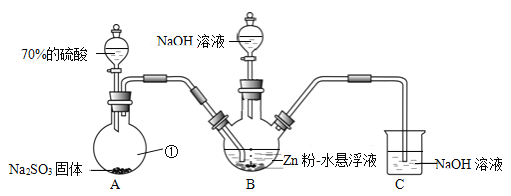
(1)仪器①的名称是______。
(2)B装置用于制备Na2S2O4。第一步反应:Zn+2SO2  ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为______。
ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为______。
(3)B装置反应前,先进行的实验操作是______。
(4)反应后除去B中的沉淀,在滤液中加入一定量的NaCl固体搅拌,有Na2S2O4晶体析出。加入NaCl固体的作用是______。
Ⅱ.探究Na2S2O4的性质
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是______。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液)
(6)制备纳米级银粉:用NaOH溶液溶解Na2S2O4,加入一定量的AgNO3溶液,生成纳米级的银粉。在制备银粉的反应中,氧化剂和还原剂的物质的量之比为2︰1,且生成的含硫物质只有一种,写出该反应的离子方程式______。
-
Na2S2O4•2H2O俗称保险粉,常用做纺织工业的漂白剂、脱色剂等。某科研小组制备并探究其性质。
资料:Na2S2O4•2H2O的性质:易溶于水,不溶于乙醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。
I.制备Na2S2O4•2H2O(加热等辅助仪器略去)
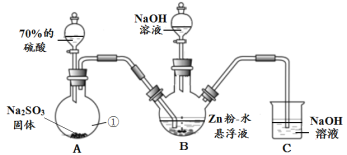
(1)仪器① 的名称是___________。
(2)B装置用于制备Na2S2O4•2H2O。第一步反应:Zn+2SO2  ZnS2O4;第二步,加入NaOH溶液,于28~35℃ 反应生成Na2S2O4,反应的化学方程式为______________________。
ZnS2O4;第二步,加入NaOH溶液,于28~35℃ 反应生成Na2S2O4,反应的化学方程式为______________________。
(3)检查装置气密性,装入药品。在加热B装置前,先进行的实验操作是______________。
(4)反应后除去B中的沉淀,在滤液中加入一定量的NaCl固体搅拌,有Na2S2O4•2H2O晶体析出。加入NaCl固体的作用是______________________________________________。
(5)制得的Na2S2O4•2H2O粗产品,需要用乙醇洗涤。下列说法中,不属于用乙醇洗涤的目的的是________。
A.防止晶体溶解,提高产率 B.利用乙醇的挥发性,促进晶体表面水的挥发
C.防止晶体失水而风化 D.利用乙醇蒸气的保护作用,防止晶体被氧化
II.探究Na2S2O4•2H2O的性质
(6)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。设计实验证明该分解产物中含有Na2SO4。实验方案是________________________________________________(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液)
III.测定Na2S2O4•2H2O的纯度
(7)取所制得的样品2.500g于锥形瓶中,加入20mL水,振荡,使之完全溶解,然后用0.5000mol•L-1 KMnO4溶液滴定,达到滴定终点时共用去24.00 mL KMnO4溶液。样品的纯度是______________。
-
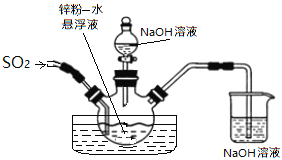
连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制备二氧化硫。
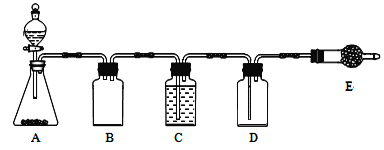
若使用上图所示装置制备干燥的SO2气体,回答以下问题:
①A中盛液体的玻璃仪器名称是____________,实验开始后A中反应的化学方程式为____________。
②B装置的作用是_______________________。
③C装置的试剂为__________________,E中固体试剂为________________。
(2)制备保险粉(略)。
(3)测定保险粉纯度。
Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4 + 6KMnO4 + 4H2SO4 = 5Na2SO4 + 3K2SO4 + 6MnSO4 + 4H2O,称取3.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于试管中,用0.10mol·L-1的KMnO4溶液滴定。
①滴定时KMnO4溶液装在__________________(玻璃仪器)中。
②滴定终点的标志_______________________________________________________。
重复上述操作2次,平均消耗KMnO4溶液18.00 mL则该样品中Na2S2O4的质量分数为____________(杂质不参与反应)。
-
连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制备二氧化硫
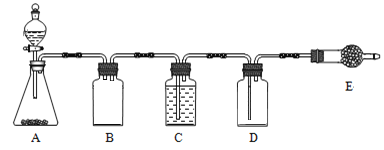
若使用上图所示装置制备干燥的SO2气体,回答以下问题:
①A中盛液体的玻璃仪器名称是____________,实验开始后A中反应的化学方程式为______________________________________________________。
②B装置的作用是_______________________;C装置的作用____________________。
③E中固体试剂为________________。
(2)制备保险粉
如下图,维持35~45℃通SO2至锌粉-水悬浮液反应生成ZnS2O4;然后加入18%的氢氧化钠溶液,在28~35℃下反应生成Na2S2O4和Zn(OH)2悬浮液。
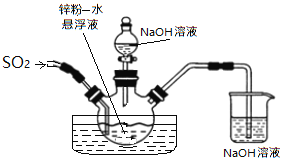
反应物经压滤除去氢氧化锌沉淀后,往滤液中加入氯化钠,并冷却至20℃,使Na2S2O4结晶析出,滤出晶体后用酒精脱水干燥即得产品。
①在制取Na2S2O4过程中发生了氧化还原反应,氧化剂是___________;生成1mol Na2S2O4转移电子______mol。
②滤液中加入氯化钠使_______离子浓度增大,促进Na2S2O4结晶析出;滤出晶体后用酒精脱水干燥是因为Na2S2O4在酒精中的溶解度_______(填“较大”或“较小”),且酒精易挥发。
③制取Na2S2O4也常用甲酸钠法,控制温度70~80℃,在甲醇溶液(溶剂)中溶解甲酸钠(HCOONa),再滴加Na2CO3溶液同时通SO2维持溶液微酸性,即可生成Na2S2O4,反应的离子方程式:_________________________________________。
(3)测定保险粉纯度
Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4 + 6KMnO4 + 4H2SO4 = 5Na2SO4 + 3K2SO4 + 6MnSO4 + 4H2O
称取3.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于试管中,用0.10mol·L-1的KMnO4溶液滴定。
重复上述操作2次,平均消耗KMnO4溶液18.00 mL则该样品中Na2S2O4的质量分数为_____________(杂质不参与反应)。
-
连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制备二氧化硫
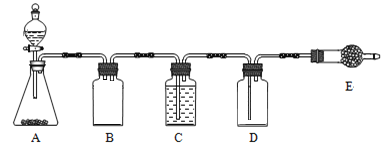
若使用上图所示装置制备干燥的SO2气体,回答以下问题:
①A中盛液体的玻璃仪器名称是____________,实验开始后A中反应的化学方程式为______________________________________________________。
②B装置的作用是_______________________;C装置的作用____________________。
③E中固体试剂为________________。
(2)制备保险粉
如下图,维持35~45℃通SO2至锌粉-水悬浮液反应生成ZnS2O4;然后加入18%的氢氧化钠溶液,在28~35℃下反应生成Na2S2O4和Zn(OH)2悬浮液。
反应物经压滤除去氢氧化锌沉淀后,往滤液中加入氯化钠,并冷却至20℃,使Na2S2O4结晶析出,滤出晶体后用酒精脱水干燥即得产品。
①在制取Na2S2O4过程中发生了氧化还原反应,氧化剂是___________;生成1mol Na2S2O4转移电子______mol。
②滤液中加入氯化钠使_______离子浓度增大,促进Na2S2O4结晶析出;滤出晶体后用酒精脱水干燥是因为Na2S2O4在酒精中的溶解度_______(填“较大”或“较小”),且酒精易挥发。
③制取Na2S2O4也常用甲酸钠法,控制温度70~80℃,在甲醇溶液(溶剂)中溶解甲酸钠(HCOONa),再滴加Na2CO3溶液同时通SO2维持溶液微酸性,即可生成Na2S2O4,反应的离子方程式:_________________________________________。
(3)测定保险粉纯度
Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4 + 6KMnO4 + 4H2SO4 = 5Na2SO4 + 3K2SO4 + 6MnSO4 + 4H2O
称取3.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于试管中,用0.10mol·L-1的KMnO4溶液滴定。
重复上述操作2次,平均消耗KMnO4溶液18.00 mL则该样品中Na2S2O4的质量分数为_____________(杂质不参与反应)。
-
连二亚硫酸钠(Na2S2O4)俗称保险粉,是白色砂状或淡黄色粉末状固体,易溶于水、不溶于醇,该物质具有强还原性,在空气中易被氧化为NaHSO4,75℃以上会分解产生SO2。是重要的有机合成原料和漂白剂。
制取Na2S2O4常用甲酸钠法:控制温度60~70℃,在甲酸钠(HCOONa)的甲醇溶液中,边搅拌边滴加Na2CO3甲醇溶液,同时通入SO2,即可生成Na2S2O4。反应原理如下:2HCOONa+4SO2+Na2CO3=2Na2S2O4+H2O+3CO2
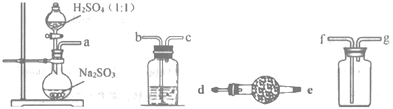
(1)如图,要制备并收集干燥纯净的SO2气体,接口连接的顺序为:a接__,__接__,__接__。制备SO2的化学方程式为___。
(2)实验室用图装置制备Na2S2O4。

①Na2S2O4中硫元素的化合价为___。
②仪器A的名称是___。
③水浴加热前要通一段时间N2,目的是___。
④为得到较纯的连二亚硫酸钠,需要对在过滤时得到的连二亚硫酸纳进行洗涤,洗涤的方法是___。
⑤若实验中所用Na2SO3的质量为6.3g,充分反应后,最终得到mg纯净的连二亚硫酸钠,则连二亚硫酸钠的产率为___(用含m的代数式表示)。
-
Na2S2O4俗称保险粉,大量用于漂白纸张和印染工业。某学习小组用下列方法制备该物质。
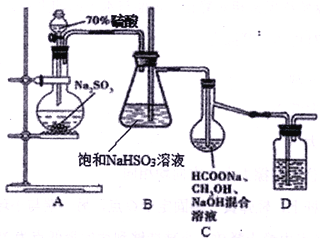
①把甲酸溶于甲醇溶液,再和足量的NaOH溶液混合配成溶液;
②制取SO2并通入上述溶液中,一段时间后可获得保险粉。
(已知:Na2S2O4在水中溶解度较大,在甲醇中溶解度较小)装置如上图所示
(1)A装置中反应的化学方程式为__________________________,为了液体顺利下滴A装置中的分液漏斗改为__________(仪器名称)更合适。
(2)B装置的作用为_____________________________, D中盛放的试剂为 ___________________。
(3)C装置的主要玻璃仪器名称为_________,足量SO2气体通入混合溶液中,生成保险粉的同时生成一种气体,则C中反应的化学方程式为______________________________。
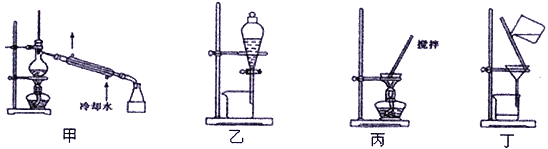
(4)分离C装置中产品Na2S2O4时应选用下列装置__________(填甲、乙、丙、丁,下同),回收甲醇的装置为_______________________。
(5)保险粉在空气中容易吸收氧气而发生氧化.其方程式可能为:
①2 Na2S2O4+O2+2H2O=4NaHSO3 或②Na2S2O4+O2+H2O=NaHSO3+NaHSO4
请设计实验证明氧化时有反应②发生:__________________________________________。
-
2016年8月17日,广东警方查获黑窝点非法使用Na2S2O4等浸泡食物来达到保鲜作用,Na2S2O4俗称保险粉,大量用于漂白纸张和印染工业。某学习小组用下列方法制备该物质。
①把甲酸(HCOOH)溶于甲醇溶液,再和足量的NaOH溶液混合配成溶液;
②制取SO2并通入上述溶液中,一段时间后可获得保险粉。
(已知:Na2S2O4在水中溶解度较大,在甲醇中溶解度较小)
装置如图所示:
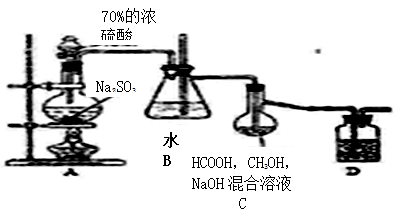
(1)A装置中的分液漏斗改为 (仪器名称)更合适,D中盛放的试剂为 。
(2)B装置的作用为 ;
(3)C装置内发生的化学反应方程式为 。
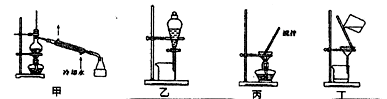
(4)分离C装置中产品时就选用下列装置 (填甲、乙、丙、丁,下同),回收乙醇的装置为 。
(5)Na2S2O4在碱性环境中除去废水中的CrO42-及+4价S的化合物,反应的离子方程式为 。














