-
某同学按照实验要求,用50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热。下列说法中正确的是
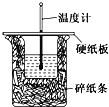
A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若烧杯上不盖硬纸板,测得的ΔH将偏小
-
某同学按照实验要求,用50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热。下列说法中正确的是
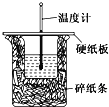
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若烧杯上不盖硬纸板,测得的ΔH将偏小
-
某同学按照课本实验要求,用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH 溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。下列说法正确的是( )

A.实验过程中没有热量损失
B.烧杯间填满碎纸条的作用是固定小烧杯
C.图中实验装置缺少环形玻璃搅拌棒
D.若将盐酸体积改为60 mL,理论上所求中和热不相等
-
某同学按照课本实验要求,用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH 溶液在图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。下列说法正确的是( )
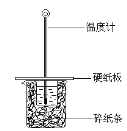
A. 实验过程中没有热量损失
B. 烧杯间填满碎纸条的作用是固定小烧杯
C. 图中实验装置缺少环形玻璃搅拌棒
D. 若将盐酸体积改为60 mL,理论上所求中和热不相等
-
某同学按照课本实验要求,用50mL 0.50mol•L﹣1的盐酸与50mL 0.55mol•L﹣1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应 过程中所放出的热量计算中和热.下列说法中,正确的是( )
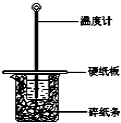
A.实验过程中没有热量损失
B.烧杯间填满碎纸条的作用是固定小烧杯
C.图中实验装置缺少环形玻璃搅拌棒
D.若烧杯上不盖硬纸板,测得的△H将偏小
-
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaO H溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
H溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
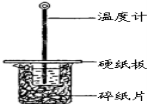
(1)下列说法不正确的是( )
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________;
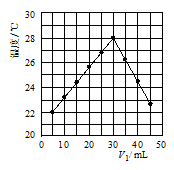
(4)若将V1mL1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 __________ ;
-
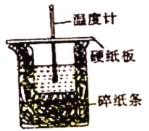
Ⅰ.(1)同学用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液测定计算中和反应的反应热。回答下列向题:
从实验装置上看,图中缺少的一种玻璃用品是_______。如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将___填“偏大”、“偏小”或“无影响”)。已知稀盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时,放出5.73kJ的热量,则表示该反应中和热的热化学方程式为________。
(2)乙同学用另一装置将V1 mL 1.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。回答下列问题:
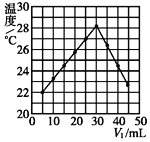
做该实验时,环境温度__(填“高于”、“低于”或“等于”)22℃。根据图计算该NaOH溶液的浓度约是__mol·L-1。
II.某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
| 示意图 | 序号 | 温度 | 试剂A | 现象 |
| 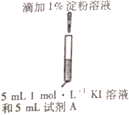
| ① | 0℃ | 0.5 mol·L-1稀硫酸 | 4min左右出现蓝色 |
| ② | 20℃ | | 1min左右出现蓝色 |
| ③ | 20℃ | 0.1 mol·L-1 稀硫酸 | 15min左右出现蓝色 |
| ④ | 20℃ | 蒸馏水 | 30min左右出现蓝色 |
(1)为探究量度对反应速率的影响,实验②中试剂A应为___。
(2)写出实验③中I-反应的离子方程式_____。
(3)对比实验②③④,可以得出的结论是_________。
(继续探究)溶液pH对反应速率的影响
查阅资料:
i.pH<11.7时,I-能被O2氧化为I2-。
ii.pH>9.28时,I2-发生歧化反应:3I2-+6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快
(4)小组同学用4支试管在装有O2储气瓶中进行实验,装置如图所示。
| 序号 | ⑤ | ⑥ | ⑦ | ⑧ |
| 试管中溶液的pH | 8 | 9 | 10 | 11 |
| 放置10小时后的现象 | 出现蓝色 | 颜色无明显变化 |
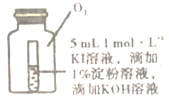
pH为10、11时,试管⑦和⑧中颜色无明显变化的原因是__(填序号)。
A 发生氧化反应又发生歧化反应,歧化反应速率大于氧化反应速率和淀粉变色速率
B 发生氧化反应又发生歧化反应,歧化反应速率小于氧化反应速率和淀粉变色速率
C 生了氧化反应,但没有发生歧化反应
D 生了歧化反应,但没有发生氧化反应
-
为探究测定中和热的实验,小明利用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3 kJ/mol)。
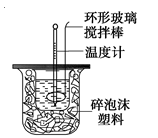
(1)写出实验所进行的中和反应的热化学方程式 。
(2)实验装置中,烧杯间填满碎纸条的作用为  。
。
(3)该实验中,使用浓度略大于盐酸的NaOH溶液的原因是 ,若改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1,NaOH溶液进行反应,所求中和热的数值_________(填“相等”或“不相等”),理由是 。
(4)小明利用上述装置做实验,测得中和热的数值偏低,请你分析可能的原因是 。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.做本实验的当天室温较高
C.将量筒中的NaOH(aq)倒入小烧杯时动作迟缓
D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大
-
50 mL 0.50 mol·L-1 盐酸与 50 mL 0.55 mol·L -1 NaOH 溶液在图示的装置中进行中和反应。通过测定反应过程中的热量可计算中和热。回答下列问题:
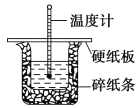
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________________
(2)烧杯间填满碎纸条的作用是______________________ 。
(3)从下列选项中选出倒入NaOH溶液的正确操作________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(4)大烧杯上如不盖硬纸板,求得的中和热数值将______ (填“偏 大”、“偏小”或“无影响”)。
(5)实验中改用60 mL 0.50 mol·L-1 盐酸跟 50 mL 0.55 mol·L-1 NaOH 溶液进行反应,与上述实验相比,所放出的热量________(填“变大”、“变小”或“不变”),所求中和热________(填“变大”、“变小”或“不变”)
(6)用50 mL 0.50 mol·L-1 CH3COOH 溶液(已知CH3COOH 电离时吸热)进行上述实验,测得的中和热的数值会________。(填“偏大”、“偏小”或“无影响”)
-
(14分)50 mL 0.50 mol・L-1盐酸与50 mL 0.55 mol・L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
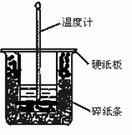
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验改用60 mL 0.50 mol・ L-1盐酸跟50 mL 0.55 mol・ L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol・L-1NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)













