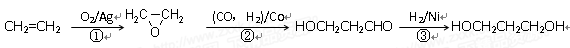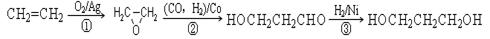-
甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g) CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ∆H1=-890.3kJ·mol-1
CO(g)+ O2(g)=CO(g) ∆H2=-283.0kJ·mol-1
O2(g)=CO(g) ∆H2=-283.0kJ·mol-1
H2(g)+ O2(g)=H2O(l) ∆H3=-285.8kJ•mol-1
O2(g)=H2O(l) ∆H3=-285.8kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ∆H4=-41.0kJ•mol-1
则甲烷水蒸气重整反应的△H=__kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
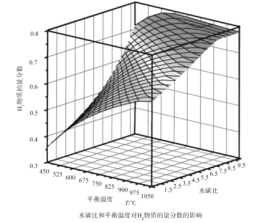
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__;其原因是__。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为__,其压强平衡常数为__;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=__(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
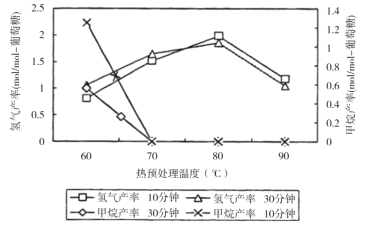
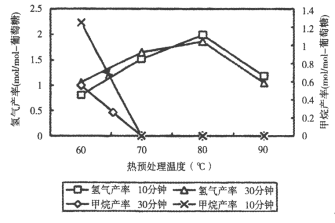
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为__;与甲烷水蒸气重整制氢相比其优点有__(至少写两点)。

-
甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g) CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ∆H1=-890.3kJ·mol-1
CO(g)+ O2(g)=CO(g) ∆H2=-283.0kJ·mol-1
O2(g)=CO(g) ∆H2=-283.0kJ·mol-1
H2(g)+ O2(g)=H2O(l) ∆H3=-285.8kJ•mol-1
O2(g)=H2O(l) ∆H3=-285.8kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ∆H4=-41.0kJ•mol-1
则甲烷水蒸气重整反应的△H=__kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
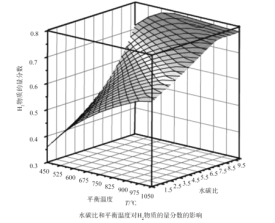
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__;其原因是__。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为__,其压强平衡常数为__;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=__(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为__;与甲烷水蒸气重整制氢相比其优点有__(至少写两点)。
-
甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g) CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1
CO(g)+0.5O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1
H2(g)+0.5O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH4=-41.0kJ·mol-1
则甲烷水蒸气重整反应的ΔH=_____kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
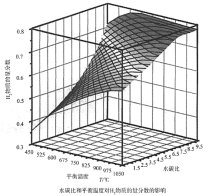
①温度一定时,H2的物质的量分数与水碳比(1~10)的关系是_____,产生该结论的原因是_____。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为_____,其压强平衡常数为_____;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率v=_____。
(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为_____。
-
氢气作为新能源,广泛应用于能源、化学等领域。现阶段氢气主要通过天然气重整的方式进行工业生产。发生的化学方程式如下:
反应I CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206 kJ/mol
CO(g)+3H2(g) △H1=+206 kJ/mol
反应II CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41 kJ/mol
CO2(g)+H2(g) △H2=-41 kJ/mol
副反应 CH4(g) C(s)+2H2(g) △H3=+75 kJ/mol
C(s)+2H2(g) △H3=+75 kJ/mol
(1)①若仅发生反应I,为提高CH4的平衡转化率,宜采用的反应条件为_________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
②某研究小组在一定条件下往恒温恒容的密闭容器中通入一定量的甲烷和水蒸气,实验过程中发现CO2的产率远大于CO的产率,请解释可能的原因________________。
(2)在实际生产过程中,科学家发现使用Ni作为催化剂(当Ni表面吸附大量碳时,会导致催化剂活性下降),可加快反应I的反应速率,从而加快整个反应的进行,提高单位时间内H2的产率。
①某恒容体系中,压强为1.3MPa,水/甲烷的物质的量之比为4,反应相同时间,H2的物质的量随反应温度的变化曲线如图所示。
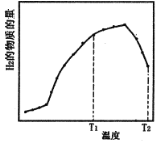
下列说法正确的是__________
A.对反应I而言,KT1>KT2
B.水/甲烷的物质的量之比等于4,大于初始反应的化学计量数之比,有利于促进CH4的转化,同时也有利于CO转化为CO2
C.使用Ni做催化剂,可增加活化分子百分数,从而加快反应速率,其主要原因是提高分子自身所具有的能量
D.若控制其他条件不变,缩小体积,则CH4的平衡转化率将减小
②在某恒温体系中,体积为1L,水/甲烷的物质的量之比等于4,投入CH4的量为l mol,若仅发生上述一系列反应,一段时间后,测得CH4的转化率为a,其中生成CO的选择性(转化的CH4中,生成CO的百分含量)为b,CO2的浓度为c mol/L,求此时H2的物质的量浓度为___________,CO的物质的量浓度为______________
(3)现科学家发现,以Ni-CaO为复合催化剂能在一定程度上促进天然气重整反应的正向进行,使H2体积分数达到95%左右。请从能量利用及平衡移动角度,理论分析以Ni-CaO为复合催化剂的优点_____________________________________________。
(4)CH4自身也可做为然料电池的原料,其工作原理如图所示。
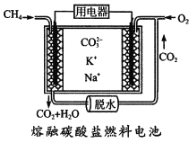
请写出通入甲烷-极的电极反应式为_______________________________________。
-
I.(1)利用水蒸气或二氧化碳对甲烷进行重整是提高甲烷利用率的重要方式水蒸气重整:
CH4(g)+H2O(g)  CO(g)+3H2(g) △H1=+205.9 KJ·mol-1 ①
CO(g)+3H2(g) △H1=+205.9 KJ·mol-1 ①
CO(g)+H2O(g)  CO2(g)+H2(g) △H 2 =-41.2 KJ·mol-1 ②
CO2(g)+H2(g) △H 2 =-41.2 KJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g)  2CO(g)+2H2(g) △H 3 ③
2CO(g)+2H2(g) △H 3 ③
则反应①自发进行的条件是____________,△H3 =___________KJ·mol-1
Ⅱ.2017年7月10日我国甲烷、二氧化碳重整制合成气装置在山西实现全系统运行,减少了温室气体的排放。
(2)某2L恒容密闭容器中,投入2 mol CH4和2 mol CO2,不同温度下平衡体系中CH4和CO的物质的量分数 /(y)%随温度变化如右图所示:
/(y)%随温度变化如右图所示:
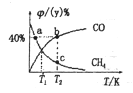
①T1温度下该反应的平衡常数是_________
②2c点CH4的物质的量分数为_________
③v逆:a_________b点(填“>”、“<”、“=”、“无法确定”),理由是________。
(3)现有温度相同的I、II、III三个恒压密闭容器,均已充入1 mol CH4(g)和1 mol CO2(g),三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的的情况下,反应进行到tmin时,CO2的体积分数如下图,此时I、II、III三个容器中可能处于化学平衡状态的是_________。

III.(4)以多孔石墨为阳极,以NaCl和NaOH的混合溶液作电解液,用电解法由甲烷制取甲醇。写出阳极的电极反应式:________________。
-
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g) +H2O(g)=CO(g) +3H2(g) △H>0,在一定条件下,向体积为1L的密闭容器中充入1 mol CH4 (g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化 曲线如图所示,下列说法正确的是
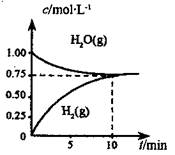
A.达平衡时,CH4( g)的转化率为75%
B.0~10 min 内,v(CO)=0.075 mol•L-1·min-1
C.该反应的化学平衡常数K=0.1875 mol•L-1
D.当CH4(g)的消耗速率与H2O(g)的生成速率相等,反应到达平衡
-
利用焦炭或天然气制取廉价的CO和H2,再用于有机合成是目前工业生产的重要途径.回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O═CO+3H2.部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热 |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O (g)转变为1mol H2O(l)时放出44.0kJ热量.则CH4和水蒸气在高温下反应生成1mol H2的反应热为______.
(2)用CO和H2在一定条件下合成甲醇:CO+2H2⇌CH3OH.工业上采用稍高的压强(5MPa)和250℃,其可能原因是______.
| 反应温度/℃ | 平衡常数 | 反应温度/℃ | 平衡常数 |
| 667.30 | 200 | 1.909×10-2 |
| 100 | 12.92 | 300 | 2.42×10-4 |
(3)1,3-丙二醇是重要的化工原料,用乙烯合成1,3-丙二醇的路线如下:
CH2=CH2 HOCH2CH2CHO
HOCH2CH2CHO  HOCH2CH2CH2OH
HOCH2CH2CH2OH
某化工厂已购得乙烯11.2t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O CO+H2 CH4+H2O
CO+H2 CH4+H2O  CO+3H2
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%.且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?______.
-
(12分)利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式________。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,,此时N2的转化率为a。则平衡时NH3的浓度为________。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
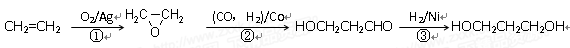
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O CO+H2 CH4+H2O
CO+H2 CH4+H2O CO+3H2
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭________吨、甲烷________吨,
才能满足生产需要。
-
 利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O CO+3H2。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 molNH3,反应达平衡后测得平衡常数为K,此时CH4的转化率为a。则K和a的关系是K=。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
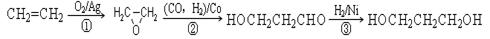
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:C+H2O CO+H2 CH4+H2O
CO+H2 CH4+H2O CO+3H2
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
-
氢气是热量高、无污染的燃料,天然气储量丰富是理想的制氢原料,研究甲烷制氢具有重要的理论和现实意义。
(1)甲烷水蒸气重整制氢:CH4(g)+H2O(g) CO(g)+3H2(g)△H1=+216kJ•mol-1,温度1200k,压强0.2Mpa,水碳起始物质的量之比3:1,达到平衡时氢气的物质的量分数为0.3,甲烷转化率为____,Kp=____(Mpa)2 。理论上近似水碳比为____,氢气的物质的量分数将达到最大。
CO(g)+3H2(g)△H1=+216kJ•mol-1,温度1200k,压强0.2Mpa,水碳起始物质的量之比3:1,达到平衡时氢气的物质的量分数为0.3,甲烷转化率为____,Kp=____(Mpa)2 。理论上近似水碳比为____,氢气的物质的量分数将达到最大。
(2)①将甲烷水蒸气重整和甲烷氧化重整两种方法结合,理论上按照空气、甲烷、水蒸气约15:7:1体积比进料(空气中氧气体积分数约为0.2),可以实现反应器中能量自给(不需要补充热量)。
甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2=____kJ•mol-1
②实际生产中,空气、甲烷、水蒸气按照约1:1:2体积比进料,增加水蒸气的作用是____,还能发生____(用化学方程式表示)反应,从而获得更多的氢气。
(3)甲烷水蒸气重整过程中,温度1000K,原料气以57.6Kg•h-1通入容积为1L镍基催化反应器中,2-5s甲烷质量分数由7.32%变为5.32%,用甲烷表示2-5s的反应速率为____mol•min-1 ,随着反应的进行反应速率会急速下降,可能的原因是甲烷等高温不稳定,造成____。有人提出将甲烷水蒸气重整和甲烷氧化重整两种方法结合则能解决这个问题,原因是____。
CO(g)+3H2(g)。回答下列问题:
O2(g)=CO(g) ∆H2=-283.0kJ·mol-1
O2(g)=H2O(l) ∆H3=-285.8kJ•mol-1




 CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题: