-
研究CO、CO2的回收利用既可变废为宝,又可减少碳的排放。请回答下列问题:
(1)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”,由CO和H2制备二甲醚的反应原理如下:
CO(g)+2H2(g)⇌CH3OH(g) △H=-90.1kJ/mol
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H=-24.5kJ/mol
已知:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41.0kJ/mol
则2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)的△H=________
(2)T1K时,将1mol二甲醚引入一个抽真空的150L恒容密闭容器中,发生分解反应CH3OCH3(g)⇌CH4(g)+H2(g)+CO(g)。
在不同时间测定容器内的总压,所得数据见下表,
| 反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
| 气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由表中数据计算,0~6.5min内的平均反应速率)(CH3OCH3)=___
mol⋅L-1⋅min-1(结果保留两位有效数字)反应达平衡时,二甲醚的分解率为___,该温度下平衡常数K=___。
②反应达到平衡后,若升高温度,CH3OCH3的浓度增大,则该反应为___反应(填“放热”或“吸热”)。
在T2K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)=CH3CHO(g)
反应速率v=v正-v逆=k正p(CO)⋅p(CH4)-k逆p(CH3HO),k正、k逆分别为k正、k逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数KP=4.5×10-5kPa-1,则CO的转化率为20%时, =___。
=___。
-
研究CO、CO2的回收利用既可变废为宝,又可减少碳的排放。回答下列问题:
(1)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”,由CO和H2制备二甲醚的反应原理如下:
CO(g)+2H2(g) CH3OH(g) ΔH=-90.1 kJ/mol
CH3OH(g) ΔH=-90.1 kJ/mol
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ/mol
已知:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.0 kJ/mol
CO2(g)+H2(g) ΔH=-41.0 kJ/mol
则2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) 的ΔH=__________,有利于提高该反应中CO2平衡转化率的条件是______(填标号)。
CH3OCH3(g)+3H2O(g) 的ΔH=__________,有利于提高该反应中CO2平衡转化率的条件是______(填标号)。
A.高温低压 B.高温高压 C.低温低压 D.低温高压
(2)T1 K时,将1 mol二甲醚引入一个抽空的150 L恒容容器中,发生分解反应: CH3OCH3(g) CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
| 反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
| 气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由表中数据计算:0~6.5 min内的平均反应速率v(CH3OCH3)=_________,反应达平衡时,二甲醚的分解率为_______,该温度下平衡常数K=__________。
②若升高温度,CH3OCH3的浓度增大,则该反应为______反应(填“放热”或“吸热”),要缩短达到平衡的时间,可采取的措施有___________、__________。
(3)在T2 K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生如下反应: CO(g)+CH4(g) CH3CHO(g),反应速率v=v正−v逆=k正p(CO)·p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5 (kPa)-1,则CO转化率为20%时
CH3CHO(g),反应速率v=v正−v逆=k正p(CO)·p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5 (kPa)-1,则CO转化率为20%时 =_______。
=_______。
-
研究CO、CO2的回收利用既可变废为宝,又可减少碳的排放。回答下列问题:
(1)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”,由CO和H2制备二甲醚的反应原理如下:
CO(g)+2H2(g) CH3OH(g) ΔH=-90.1kJ/mol
CH3OH(g) ΔH=-90.1kJ/mol
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
已知:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.0kJ/mol
CO2(g)+H2(g) ΔH=-41.0kJ/mol
则2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)的ΔH=__,有利于提高该反应中CO2平衡转化率的条件是__(填字母)。
CH3OCH3(g)+3H2O(g)的ΔH=__,有利于提高该反应中CO2平衡转化率的条件是__(填字母)。
A.高温低压 B.高温高压 C.低温低压 D.低温高压
(2)T1K时,将1mol二甲醚引入一个的150L恒容密闭容器中,发生分解反应:CH3OCH3(g) CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
| 反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
| 气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由表中数据计算:0~6.5min内的平均反应速率v(CH3OCH3)=___,反应达平衡时,二甲醚的分解率为__。
②若要缩短该反应达到平衡的时间,可采取的措施有__、___。
(3)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g) CH3CHO(g),反应速率v=v正−v逆=k正p(CO)·p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,则CO转化率为20%时
CH3CHO(g),反应速率v=v正−v逆=k正p(CO)·p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,则CO转化率为20%时 =___。
=___。
-
研究 CO、CO2 的回收利用既可变废为宝,又可减少碳的排放。回答下列问题:
(1)T1 K 时,将 1mol 二甲醚引入一个抽空的 50L 恒容容器中,发生分解反应:CH3OCH3(g)  CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:
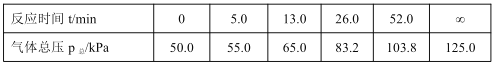
由表中数据计算:0~5.0 min 内的平均反应速率 v(CH3OCH3)=__________,该温度下平衡常数 K=_______________ 。
(2)在 T2 K、1.0×104 kPa 下,等物质的量的 CO 与 CH4 混合气体发生如下反应:CO(g)+CH4(g)  CH3CHO(g),反应速率 v正 −v逆=k正p(CO)•p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,
CH3CHO(g),反应速率 v正 −v逆=k正p(CO)•p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时, =____________。
=____________。
-
低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是一个重要研究方向, 既可变废为宝,又可减少碳的排放。工业上可用CO2和H2制备被誉为“21世纪的清洁燃料”二甲醚(CH3OCH3):
如在500℃时,在密闭容器中将炼焦中的CO2转化为二甲醚,其相关反应为:
主反应I:2CO2 (g)+6H2(g) CH3OCH3(g)+3H2O(g) △H1
CH3OCH3(g)+3H2O(g) △H1
副反应II:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
(1)已知:①CO(g)+2H2(g) CH3OH(g) △H=-90.1kJ/mol
CH3OH(g) △H=-90.1kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-24.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-24.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H= -41.0kJ/mol
CO2(g)+H2(g) △H= -41.0kJ/mol
则主反应I的△H1=______。
(2)在一定温度下某密闭容器中按CO2和H2的浓度比为1:3投料进行反应,测得不同时间段部分物质的浓度如下表:
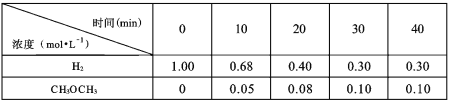
①10-20min 内,CH3OCH3的平均反应速率v(CH3OCH3)=_______。
②根据以上数据计算主反应I的平衡常数K=______(列式,代入数据,不计算结果)。
(3)欲提高CH3OCH3产率的关键的因素是选用合适的催化剂,其原因是_______。
(4)对于反应II,温度对CO2的转化率及催化剂的效率影响如图所示:下列有关说法不正确的是_______。
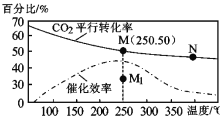
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于Ml
B.温度低于250°C时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化
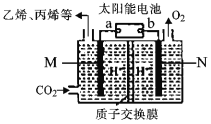
(5)利用太阳能电池将CO2转化为乙烯、丙烯等有机化工原料,其工作原理如图所示。则a为太阳能电池的_______极,写M极上生成丙烯的电极反应式为_________。
-
二甲醚(CH3OCH3)是一种新型能源,被誉为“21世纪的清洁燃料”。
(1)用CO和H2合成二甲醚的反应为:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)△H。
CH3OCH3(g)+CO2(g)△H。
几种物质的相对能量如下:
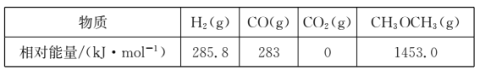
△H=______kJ·mo1。改变下列“量”,一定会引起△H发生变化的是_____(填代号)。
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
(2)有利于提高反应中CH3OCH3产率的条件为_______(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)采用新型催化剂(主要成分是Cu—Mn的合金)制备二甲醚。催化剂中n(Mn)/n(Cu)对合成二甲醚的影响情况如下图所示。
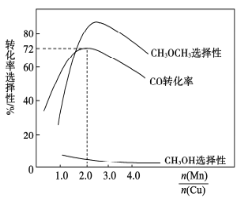
当n(Mn)/n(Cu)=2时,二甲醚的选择性(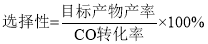 )为85.8%,此时二甲醚的产率为_________。
)为85.8%,此时二甲醚的产率为_________。
(4)用二甲醚燃料电池电解法可将酸性含铬废水(主要含有Cr2O72-)转化为Cr3+。原理如下图:
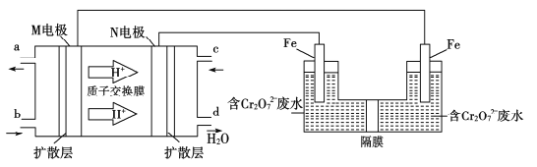
①燃料电池中的负极是______(填“M”或“N”)电极。电解池阴极的电极反应式为______________________________。
②消耗6.9g二甲醚时可处理Cr的含量为26.0g·L-1的废水1L,该套装置的能量利用率为___________。(保留3位有效数字)
-
H2S转化是环保和资源利用的研究课题。將烧碱吸收H2S后的溶液加人如图装置,可以回收单质硫,甲为二甲醚(CH3OCH3)一空气燃料电池。
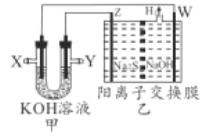
下列推断正确的是
A. Y极充入二甲醚 B. 电子由X W
W 溶液
溶液 Z
Z Y
Y
C. Z极反应式为S2--2e-=S D. 电解后,乙装置右池中c(NaOH)减小
-
Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g) + 2CO(g)  CH3OCH3(g) + H2O(g) ∆H=-198kJ/mol。
CH3OCH3(g) + H2O(g) ∆H=-198kJ/mol。
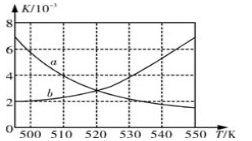
(1)如图所示能正确反映平衡常数K随温度变化关系的曲线是 (填曲线标记字母),其判断理由是 。
(2)在一定温度下,向2.0L固定的密闭容器中充入2molH2 和1molCO,经过一段时间后,反应4H2(g) + 2CO(g)  CH3OCH3(g) + H2O(g) 达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g) + H2O(g) 达到平衡。反应过程中测得的部分数据见下表:
| 时间/min | 0 | 20 | 40 | 80 | 100 |
| n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
| n(CO) /mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
| n(CH3OCH3) /mol | 0 | 0.15 | — | — | 0.4 |
| n(H2O) /mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0—20min的平均反应速率V(co)= mol/(L·min);
②达平衡时,H2 的转化率为: ;
③在上述温度下,向平衡后的2L容器中再充入0.4molH2 和0.4molCH3OCH3 (g),则化学平衡 (向“正向”、“逆向”或“不”)移动。
(3)用Li2CO3 和Na2CO3 的熔融盐混合物作为电解质,CO为负极燃气,空气与CO2 的混合气体作为正极助燃气,制得在650℃工作的燃料电池,则负极反应式为:
,当燃料电池的电路中有0.2NA个电子发生转移,则标况下生成 _______升CO2 。
Ⅱ:已知在25℃时,Ksp[Mg(OH)2 ]=1.8X10-11,Ksp[Cu(OH)2 ]=2.2X10-20,在25℃下,向浓度均为0.1mol/L的MgCl2 和CuCl2 混合溶液中逐滴加入氨水,先生成 沉淀(填化学式)生成该沉淀的离子方程式为 。
-
二氧化碳捕集、存储和转化是当今化学研究的热点问题之一。
(1)CO2转化途径之一是利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇(CH3OH)、二甲醚(CH3OCH3)等。已知:
甲醇合成反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1
二甲醚合成反应:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.5kJ·mol-1
则由H2和CO2制备二甲醚2CO2(g)+6H2(g)=CH3OCH3(g) +3H2O(g)的△H____kJ·Mol-1
+3H2O(g)的△H____kJ·Mol-1
(2)甲醇是一种可再生的清洁能源,具有开发和应用的广阔前景。
已知:25℃,1.01×105Pa时,1.6g液态甲醇完全燃烧,当恢复到原状态时,放出36.29kJ的热量,写出表示甲醇燃烧热的热化学方程式________________________________。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下,将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H2O+2H+;2HNO2+O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1.0g铵态氮元素转化为硝态氮元素时需氧气的质量为_______g。
②写出加入甲醇后反应的离子方程式:_______________________________________。
-
研究CO、CO2的回收对减少碳的排放、改善生态环境和构建生态文明具有重要的意义。回答下列问题:
(1)已知:①CO(g)+2H2(g) CH3OH(g) ΔH=−99 kJ·mol−1
CH3OH(g) ΔH=−99 kJ·mol−1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41 kJ·mol−1
CO(g)+H2O(g) ΔH=+41 kJ·mol−1
则反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=_________。
CH3OH(g)+H2O(g) ΔH=_________。
(2)向容积相同的三个恒容密闭容器中分别通入一定量H2、CO,控制适当条件使其发生反应:2H2(g)+CO(g) CH3OH(g),反应中有关数据如下表所示:
CH3OH(g),反应中有关数据如下表所示:
| 容器 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L |
| c(H2) | c(CO) | c(CH3OH) |
| A | 350 | 0.40 | 0.20 | 0.16 |
| B | 350 | 0.80 | 0.40 | |
| C | T | 0.40 | 0.20 | 0.05 |
反应从开始到达到平衡时,平均反应速率:容器A____容器C(填“>”或“<”,后同),容器B中CO的转化率____80%。
(3)①CO2和H2在一定条件下能发生如下反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中充入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中充入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
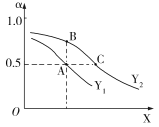
X表示___(填“温度”或“压强”),状态A、B、C对应的平衡常数K(A)、K(B)、K(C)的相对大小顺序为_____。
②向M、N两个初始容积相同的密闭容器中各充入2 mol CO2 和6 mol H2,控制适当条件使其发生如下反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
(4)用NaOH溶液做碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=10的溶液,则溶液中c( )∶c(
)∶c( )=___________[K1(H2CO3)=4.4×10−7、K2(H2CO3)=5×10−11],溶液中c(Na+)_______ c(
)=___________[K1(H2CO3)=4.4×10−7、K2(H2CO3)=5×10−11],溶液中c(Na+)_______ c( )+2c(
)+2c( )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
CH3OH(g) ΔH=-90.1kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CO2(g)+H2(g) ΔH=-41.0kJ/mol
CH3OCH3(g)+3H2O(g)的ΔH=__,有利于提高该反应中CO2平衡转化率的条件是__(填字母)。
CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
CH3CHO(g),反应速率v=v正−v逆=k正p(CO)·p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,则CO转化率为20%时
=___。






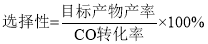 )为85.8%,此时二甲醚的产率为_________。
)为85.8%,此时二甲醚的产率为_________。


