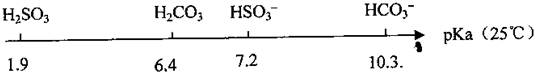-
已知H2SO3⇌HSO3-+H+,Ka1;HSO3-⇌SO32-+H+,Ka2。常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )

A.pH=1.2溶液中:c(Na+)+c(H+)=c(OH-)+c(H2SO3)
B.常温下, =1000
=1000
C.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度先增大后减小
D.曲线3表示的微粒是SO32-
-
饱和亚硫酸溶液的pKa(电离平衡常数的负对数,即pKa=-lgKa)数据如下:
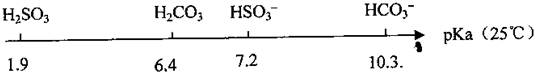
(1)比较H2SO3的Ka1和HSO3-的Ka2,Ka1______Ka2(填‘‘>”、“<’’或“=”,下同)
(2)0.01mol.L-1NaHSO3溶液的pH=bl,0.01mol•L-1NaHCO3溶液的pH=b2,b1______b2
(3)向10mL 0.01mol•L-1的H2SO3溶液中,滴加0.0l mol•L-1KOH溶液V(mL),
①当V=10mL时,溶液中存在:c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)______ c(OH-)
②当V=a mL时,溶液中离子浓度有如下关系:c(K+)=2c(SO32-)+c(HSO3-);当V=b mL时,溶液中离子浓度有如下关系:
c(K+)=c(SO32-)+c(HSO3-)+c(H2SO3);则a______b.
(4)已知25℃时,Ksp(BaSO4)=1×10-10,将0.1gBaSO4沉淀,分别用100mL蒸馏水和100mL 0.01mo1.L-1H2SO4溶液洗涤,两种洗涤方法中BaSO4沉淀的损耗量之比为______.
-
常温下,Ka1 (H2SO3)=1.5×10-2,Ka2=1.0×10-7,Kb (NH3·H2O) =1.76×10-5,设H2SO3溶液中c(总)=c( )+c(
)+c( )+c(H2SO3)。室温下将氨气通入25.00 mL 0.1000 mol·L−1H2SO3溶液中(忽略溶液体积变化),下列说法正确的是
)+c(H2SO3)。室温下将氨气通入25.00 mL 0.1000 mol·L−1H2SO3溶液中(忽略溶液体积变化),下列说法正确的是
A.溶液中始终存在:c( )+c(H+ )=c(
)+c(H+ )=c( )+c(
)+c( )+c(OH−)
)+c(OH−)
B.在NH4HSO3溶液中:c( )>c(
)>c( )>c(NH3·H2O)>c(H2SO3)
)>c(NH3·H2O)>c(H2SO3)
C.pH=7的溶液:c( )=2c(
)=2c( )+c(
)+c( )
)
D.c( )=2c(总)的溶液中:c(NH3·H2O)+c(OH−)=c(H+ )+c(
)=2c(总)的溶液中:c(NH3·H2O)+c(OH−)=c(H+ )+c( )+2c(H2SO3)
)+2c(H2SO3)
-
常温时,下列各溶液中,微粒的物质的量浓度关系正确的是
A.pH = 5的NaHSO3溶液:[HSO3-]>[H2SO3]>[SO32-]
B.pH = 8的苯酚与苯酚钠混合溶液:[Na+]>[C6H5O-]>[OH-]>[H+]
C.pH = 7 的CH3COONa与CH3COOH的混合溶液:[Na+]=[CH3COO-]+[CH3COOH]
D.0.1 mol/L NaHCO3溶液:[OH-] + [CO32-]= [H+]+[H2CO3]
-
常温下,H2SO3的电离常数:Ka1=1.54×10-2,Ka2=1×10-7。向mmL0.1mol/L H2SO3溶液中滴加0.1mol/LKOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示,下列说法正确的是
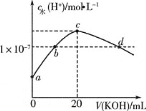
A.m=20
B.c点对应的溶液中存在c(K+)==c(HSO3-)+2c(SO32-)
C.b、d两点溶液的pH=7
D.SO32-+H2O⇌HSO3-+OH-的Kh=1×10-7
-
常温时,下列各溶液中有关粒子浓度的说法正确的是( )
A.pH=5的NaHSO3溶液:c(HSO3-) > c(SO32-)> c(H2SO3)
B.pH=3的盐酸跟pH=11的氨水等体积混合: c(H+)>c(OH-)
C.pH<7的CH3COONa和CH3COOH的混合溶液 c(Na+)> c(CH3COO-)> c(H+)>c(OH-)
D.pH=12的NaOH溶液中:c(OH-)水电离=1.0×10-12 mol/L
-
下列溶液中的微粒浓度的关系正确的是
A. 常温下,pH=5 的NaHSO3 溶液中:c(HSO3-)>c(H2SO3)>c(SO32-)
B. 0.1 mol·L-1 (NH4)2S 溶液中, c(NH4+)=2c(H2S)+2c(HS-)+2c(S2-)
C. 0.1 mol·L-1 CuSO4 溶液中, c(Cu2+)+c(H+)=c(SO42-)+c(OH-)
D. 0.1 mol·L-1NaHCO3 溶液中, c(H2CO3)+c(H+)=c(CO32-)+c(OH-)
-
常温下,下列有关溶液中微粒的物质的量浓度关系错误的是
A. pH为5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-)
B. 向NH4Cl溶液中加入NaOH固体至pH=7,所得溶液中:c(Cl-)>c(NH4+)>c(Na+)=c(NH3·H2O)>c(OH-)=c(H+)
C. 将等体积、等物质的量浓度的CH3COONH4与NaCl溶液混合:c(CH3COO-)+c(Na+) = c(Cl-) + c(NH4+)
D. 20mL 0.1mol/L NH4HSO4溶液与30mL0.1mol/L NaOH溶液混合,(pH>7):c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
-
常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-3,H2CO3的电离常数Ka1=4.4×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于____________。
请设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论)。_____。仪器自选。
供选的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸。
-
25℃时,将SO2通入蒸馏水中模拟酸雨形成过程,实验数据如图。已知Ka1(H2SO3)=10-2,Ka2(H2SO3)=10-7。下列说法不正确的是
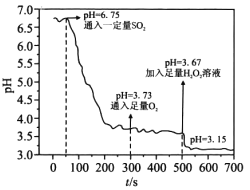
A. 300s未通O2时溶液中c(H2SO3)=10 -5.46mol·L-1
B. 400s时溶液中c(HSO3-)+c(SO32-)+c(SO42-)+c(H2SO3)≈10-3.73mol·L-1
C. 600s时,溶液中c(H+)约为c(SO42-)2倍
D. 由图推知,H2O2氧化性大于O2

=1000