-
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:

已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4C1-==2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为__________________;
(2)“反应Ⅱ”的还原剂是_______________(填化学式);
(3)“反应III”的离子方程式为____________________________________;
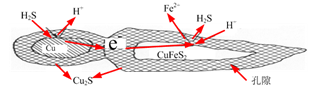
(4)辉铜矿的主要成分是Cu2S,可由黄铜矿(主要成分CuFeS2)通过电化学反应转变而成,有关转化如下如图 所示。转化时正极的电极反应式为___________________。
(5)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
①反应Cu2S+4FeCl32CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为______;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是__________。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化如图,其原因是_______________。


(6)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq) Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
-
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:

已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4C1-==2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为__________________;
(2)“反应Ⅱ”的还原剂是_______________(填化学式);
(3)“反应III”的离子方程式为____________________________________;
(4)辉铜矿的主要成分是Cu2S,可由黄铜矿(主要成分CuFeS2)通过电化学反应转变而成,有关转化如下如图 所示。转化时正极的电极反应式为___________________。
(5)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
①反应Cu2S+4FeCl32CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为______;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是__________。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化如图,其原因是_______________。


(6)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq) Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
-
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:

已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4C1-==2[CuCl2]-+S
回答下列问题:
(1) 铁红的化学式为__________________;
(2)“反应Ⅱ”的还原剂是_______________(填化学式);
(3)“反应III”的离子方程式为_______________________________________________;
(4)辉铜矿的主要成分是Cu2S,可由黄铜矿(主要成分CuFeS2)通过电化学反应转变而成,有关转化如下如图 所示。转化时正极的电极反应式为___________________。
(5)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
 ①反应Cu2S+4FeCl3 2CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为______;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是__________。
①反应Cu2S+4FeCl3 2CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为______;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是__________。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化如图,其原因是_______________。

如图 如图
(6)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq) Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
-
一种以黄铜矿和硫磺为原料制取钢和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:

已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为________;
(2)“反应Ⅱ”的还原剂是________(填化学式);
(3)除CuS外“反应II”的产物还有_________(填化学式);
(4)“反应Ⅲ”的离子方程式为_________;
(5)某同学设想利用电化学原理实现以CuSO4、SO2为原料制备Cu和H2SO4,并吸收炼铁过程中产生的CO尾气,实现资源与能源的综合利用。该同学据此组装出的装置如下图所示:
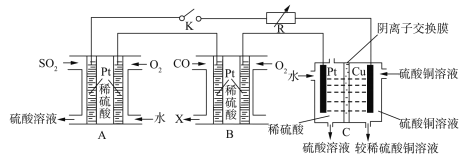
闭合该装置中的K,A池中通入SO2的Pt电极的电极反应式为__________,B池中生成的气体X的电子式为________,若在C池中生成64gCu,则整个装置中共生成H2SO4_____mol。
-
一种以黄铜矿和硫磺为原料制取钢和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:

已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为________;
(2)“反应Ⅱ”的还原剂是________(填化学式);
(3)除CuS外“反应II”的产物还有_________(填化学式);
(4)“反应Ⅲ”的离子方程式为_________;
(5)某同学设想利用电化学原理实现以CuSO4、SO2为原料制备Cu和H2SO4,并吸收炼铁过程中产生的CO尾气,实现资源与能源的综合利用。该同学据此组装出的装置如下图所示:

闭合该装置中的K,A池中通入SO2的Pt电极的电极反应式为__________,B池中生成的气体X的电子式为________,若在C池中生成64gCu,则整个装置中共生成H2SO4_____mol。
-
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高.其主要流程如下:
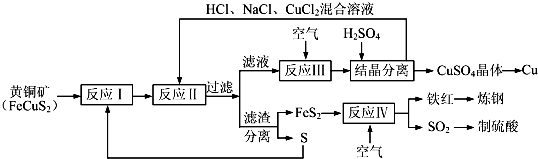
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
请回答下列问题:
(1)反应Ⅰ的产物为____________(填化学式).
(2)反应Ⅲ的离子方程式为____________;
(3)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其可能的原因是____________;
(4)反应Ⅳ在高温条件下进行,化学方程式是____________;
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol•L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL.已知:Cr2O72-+Fe2++H+→Cr3++Fe3++H2O(未配平)
①SO2通入Fe(SO4)3溶液中,发生反应的离子方程式为____________;
②反应Ⅳ所得气体中SO2的体积分数为____________。
-
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:

注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2CuCl2-+S
请回答下列问题:
⑴反应Ⅰ的产物为(填化学式)▲ 。
⑵反应Ⅲ的离子方程式为▲ 。
⑶一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
▲ 。
⑷炼钢时,可将铁红投入熔融的生铁中,该过程中主要反应的化学方程式是▲ 。
⑸某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2O72-+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为▲ 。
②反应Ⅳ所得气体中SO2的体积分数为▲ 。
-
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高,其主要流程如下:

注:反应II的离子方程式为Cu2+ +CuS+4Cl- ═2[CuCl2]-+S↓
请回答下列问题;
(1)反应I的产物为 (填化学式)。
(2)反应Ⅲ的离子方程式为 。
(3)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其可能的原因是 。
(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均成酸性,相同条件下,同浓度的两种水溶液c(SO32-)较小的是 。
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3 溶液完全反应后,用浓度为0.02000mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00Ml。 已知:Cr2O72- +Fe2+ +H+→Cr3+ +Fe3+ +H2O(未配平)反应IV所得气体中SO2的体积分数为 。
-
【化学——选修化学与技术】(15分)现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:

注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是 _____________________ ________、___________________________________ 。
(2)反应Ⅰ的产物为(填化学式) ___________________ 。
(3)反应Ⅲ的离子方程式为 ____________________________________________________ 。
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是 ___________
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
A.反应中被还原的元素只有氧 B.反应生成的SO2直接排放会污染环境
C.SO2既是氧化产物又是还原产物 D.当有8mol铜生成时,转移电子数目为100NA
(6)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2O72-+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ____________________________________ 。
②反应Ⅳ所得气体中SO2的体积分数为________________________________________________ 。
-
现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
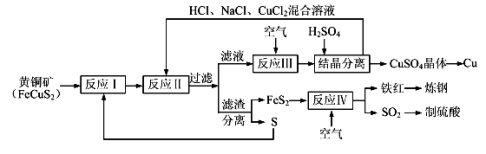
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是_____________、_____________。
(2)反应Ⅰ的产物为(填化学式)_____________。
(3)反应Ⅲ的离子方程式为_____________。
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是_____________。
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是_____________(填字母)。
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是_____________(填字母)。
A.反应中被还原的元素只有氧
B.反应生成的SO2直接排放会污染环境
C.SO2既是氧化产物又是还原产物
D.当有8mol铜生成时,转移电子数目为100NA
(6)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2O72-+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为_____________。
②反应Ⅳ所得气体中SO2的体积分数为_____________。



Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。














