-
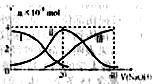
如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),向20mL0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液 , 根据图示判断,下列说法正确的是( )

A.H2A在水中的电离方程式是:H2A===H++HA-;HA- H++A2-
H++A2-
B.当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
D.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
-
常温下,向20mL0.2mol/L H2A溶液中滴加0.2mol/LNaOH溶液。有关微粒物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断下列说法正确的是

A.当y(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.欲使NaHA溶液呈中性,可以向其中加入酸或碱
D.向NaHA溶液加入水的过程中,pH可能增大也可能减小
-
常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)根据下图图示判断,下列说法错误的是( )
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)> c(A2-)>c(OHˉ)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.NaHA溶液中:c(OH-)+c(A2–)=c(H+)+c(H2A)
D.向Na2A溶液加入水的过程中,pH减小
-
如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),向20mL0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,根据图示判断,下列说法正确的是( )
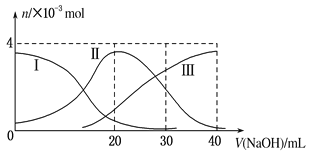
A.H2A在水中的电离方程式是:H2A=H++HA-;HA- H++A2-
H++A2-
B.当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为:c(OH-) >c(H+)
C.当V(NaOH)=40 mL时,溶液中水的电离程度比纯水大
D.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
-
常温下,向20mL0.2mol·L-1H2A溶液中滴加0.2mol.L-1NaOH溶液,溶液中微粒H2A、HA-、A2-的物质的量的变化曲线如图所示。下列说法错误的是
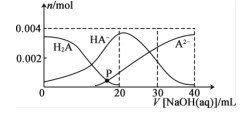
A.当V[NaOH(aq)]=20 mL时.c(OH- )=c(H+ )+c(HA- )+2c(H2A)
B.在P点时,c(Na+ )+c(H+ )=c(OH- )+c(HA- ) +c(A2- )+c(H2A)
C.当V[NaOH(aq)]=30 mL时,2c(Na+ )=3[c(HA- )+c(A2- )+c(H2A)]
D.当V[NaOH(aq)]=40 mL.时.c(Na+ )>c(A2- )>c(OH- )>c(HA- )>c(H2A)>c(H+)
-
常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
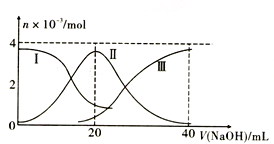
A. 当V( NaOH )= 20mL时,pH<7
B. 当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
C. 当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
D. 当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-)
-
已知某H2A的溶液中只有两种含A的微粒:HA-、A2-,常温下, 现向20mL0.2 mol/LH2A溶液中滴加0.2mol/LNaOH溶液,滴加过程中溶液pH与滴入的NaOH溶液体积关系如下图所示,下列说法中错误的是

A. HA-的电离平衡常数约为1×10-6
B. a、b、c三点对应的溶液中c点水的电离程度最大
C. c点溶液中:c(Na+) >c(A2-)>c(OH-)>c(HA-)> c(H+)
D. b 点溶液中:n(Na+) > n(A2-) =n(HA-)
-
(双选)常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断,下列说法正确的是
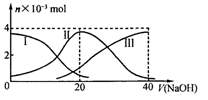
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A)
D.向Na2A溶液加入水的过程中,pH可能增大也可能减小
-
25℃时,向20 mL 0.2 mol/L H2A(某二元弱酸)溶液中滴加0.2 mol/L NaOH溶液,有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断,下列说法中正确的是
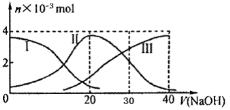
A.当V(NaOH)=20mL时,所得溶液中:c(OH-)> c(H+)
B.当V(NaOH)=30mL时,所得溶液中:2c(H+) + c(HA-) + 3c(H2A) = c(A2-) + 2 c(OH-)
C.当V(NaOH)=40mL时,所得溶液中:c(Na+)> c(A2-) >c(H+)> c(HA-) >c(OH-)
D.在NaHA溶液中:c(OH-)+2c(A2-) = c(H+)+2c(H2A)
-
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断,下列说法正确的是
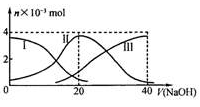
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA¯)>c(H+)> c(A2-)>c(OH¯)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中 水的电离程度比纯水的大
C.NaHA溶液中:c(OH—)+c(A2–)=c(H+)+c(H2A)
D.向Na2A溶液加入水的过程中,pH可能增大也可能减小

H++A2-







