-
50mL0.5mol/L的盐酸与50mL0.55moL/L 的 NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
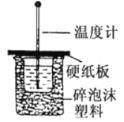
回答问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器,这种玻璃仪器的名称是_____;能否改用铁丝________ (填“能、否”),原因是____;
(2)烧杯间填满碎泡沫塑料的作用是_____;实验时氢氧化钠溶液的浓度要用 0.55 mol/L 的原因是:_____________。
(3)实验中改用 60mL0.50moL/L 盐酸跟 50mL0.55moL/L 的 NaOH 溶液进行反应,与上述实验相比,所放出的热量____ (填“偏大”“相等”或“偏小”),所求中和热_______(填“相等”或“不相等”)。
(4) 若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同, 而终止温度与起始温度差分别为①3.1℃②3.2℃ ③2.7℃,则最终代入计算式的温差均值为______ ℃ (保留 2 位小数)
(5)近似地认为 0.55mol/L NaOH 溶液和 0.5mol/L 盐酸密度都是1 g/cm3,中和后生成溶液的比热容 c=4.18 J/(g·℃), 则中和热ΔH=_____kJ/moL (取小数点后一位)
(6)上述实验数值结果与 57.3 kJ/mol 相比偏小,产生偏差的原因可能是(填字母)___________
a.实验装置保温、隔热效果差
b.配制 0.55 mol/L NaOH 溶液定容时俯视刻度线读数
c.分多次把 NaOH 溶液倒入盛有盐酸的小烧杯中
d.用温度计测定 NaOH 溶液起始温度后直接测定盐酸溶液的温度
e.用量筒量取盐酸溶液的体积时仰视读数
-
某学生通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
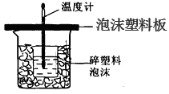
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________;由图可知该装置有不妥之处? 。
(2)实验中改用60 mL0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相 等”);所求中和热的数值会______________(填“相等”或 “不相等”)。
等”);所求中和热的数值会______________(填“相等”或 “不相等”)。
(3)该同学做实验时有些操作不规范,造成测得中和热的数 值偏低,请你分析可能的原因
值偏低,请你分析可能的原因 是
是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视计数
E.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
(4)将V1ml 1.0mol/L HCl溶液和V2ml未知浓度的NaOH溶液混合均匀后测量并记录温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)
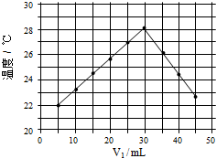
通过分析图像可知,做该实验时环境温度 (填“高于”,“低于”或“等于”)22℃,该NaOH溶液的浓度约为 mol/L。
-
50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在如图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
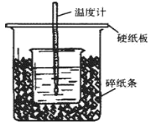
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________、_____________、________________。
(2)在测定中和热的实验中,计算反应热时需要的数据有_________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B.①②③④ C.②③④⑤ D.①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_________(填“相等”或“不相等”),所放出的热量________(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会______(填“偏大”、“偏小”或“无影响”)。
-
某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL 0.55mol/L 的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
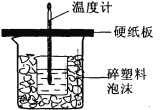
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是______,烧杯间填满碎塑料泡沫的作用是_________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用20 mL 0.50 mol/L的盐酸跟20mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是______________;所求中和热的数值会________(填“相等”或“不相等”),理由是_________________。若他测得Δt=3℃,则中和热ΔH为_______________
-
50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
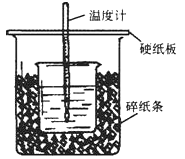
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________。
(2)烧杯间填满碎纸条的作用是____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____(填 “偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由___________
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________;(填“偏大”、“偏小”、“无影响”)。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式________ 。
-
某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )
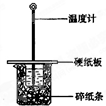
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用60mL0.50mol/L盐酸跟50mL0.5mol/L的NaOH溶液进行反应,从理论上说所求中和热不相等
-
50mL0.5mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是
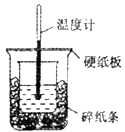
A.从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
B.大烧杯上如不盖硬纸板,测得的中和热数值会偏大
C.用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏大
D.实验中改用60mL0.5mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上实验相比,所放出的热量不相等,但是所求中和热相等
-
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
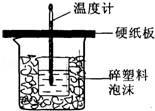
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 ,烧杯间填满碎塑料泡沫的作用是 .
(2)大烧杯上如不盖硬纸板,则求得的中和热数值 (填“偏大”、“偏小’、“无影响”)
(3)实验中改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热的数值 (填“相等”或“不相等”).
-
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
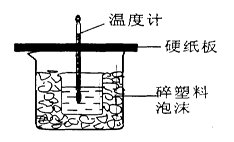
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是_____ _______。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值___________(填“偏大”、“偏小’、“无影响”)
(3)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,
与上述实验相比,所放出的热量____________(填“相等”或“不相等”),所求中和热的数值会____________(填“相等”或“不相等”),理由是_____________________________。
-
用50mL0. 50 mol•L-1盐酸与50mL0. 55mol•L-1NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
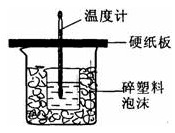
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________;
(2)烧杯间填满碎纸条的作用是________;
(3)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大、偏小、无影响”);
(4)如果用60mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等、不相等”),所求中和热______(填“相等、不相等”),简述理由__________。










