-
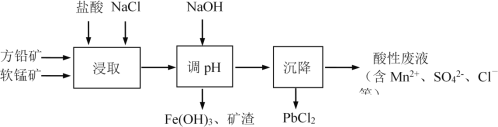
PbCl2是一种重要的化工原料,常用作制备铅黄等染料。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如图:
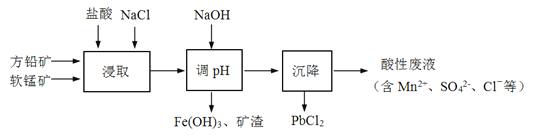
已知:ⅰ.PbCl2难溶于冷水,易溶于热水
ⅱ.PbCl2(s) + 2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(1)根据如图分析“浸取”过程的最佳反应条件是___。
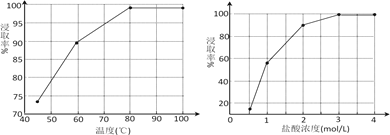
(2)“浸取”过程中盐酸与MnO2、PbS发生反应生成PbCl2的化学方程式为___。
(3)由于PbCl2难溶于冷水,容易附着在方铅矿表面形成“钝化层”,使反应速率大大降低,浸取中加入饱和NaCl溶液可有效避免这一现象,原因是___。
(4)加NaOH溶液调节pH至___时即可使Fe3+沉淀完全。
已知:该温度下:Kw=1.0×10-13mol2·L-2;Ksp[Fe(OH)3]=1×10-38mol4·L-4;c(Fe3+)≤1×10-5mol·L-1时表示Fe3+已沉淀完全。
(5)“沉降”过程中获得PbCl2采取的措施有___。
(6)通过电解酸性废液可重新获得MnO2,装置图如图:
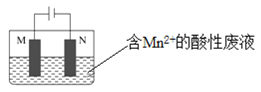
MnO2在___极(填“M”或“N”)生成,该极的电极反应式为___。
-
PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如图所示。
已知:i. PbCl2微溶于水ii. PbCl2 (s) + 2Cl-(aq)  PbCl42-(aq) ΔH > 0
PbCl42-(aq) ΔH > 0
(1)浸取过程中MnO2与PbS发生如下反应,请将离子反应配平:
___ ____+ ___ ____+___PbS + ___MnO2 ____PbCl2 + ____ ____+ ____ ____+ ___ ____
(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是________。
(3)调pH的目的是________。
(4)沉降池中获得PbCl2采取的措施有________。
(5)通过电解酸性废液可重新获得MnO2,装置示意图如下:
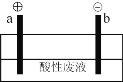
①在_______极(填“a”或“b”)获得MnO2,电极反应为________。
②电解过程中发现有Cl2产生,原因可能是_________、__________。
-
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:
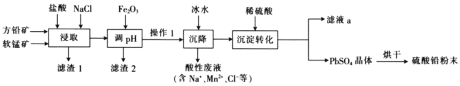
已知:i.PbCl2难溶于冷水,易溶于热水。
ii.PbCl2(s)+2Cl-(aq) PbCl42-(aq) ΔH>0
PbCl42-(aq) ΔH>0
iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5。
(1)“浸取”时需要加热,此时盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为__。
(2)“调pH”的目的是__。
(3)“沉降”操作时加入冰水的作用是__。
(4) 时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
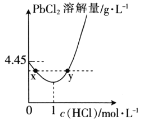
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随着HCl浓度的增大,PbCl2溶解量减小是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(5)PbCl2经“沉淀转化”后得到PbSO4,当c(Cl-)=0.1mol·L-1时,c(SO42-)=__。
(6)“滤液a”经过处理后可以返回到__工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂三盐基硫酸铅(3PbO·PbSO4·H2O),该反应的化学方程式为__。
-
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:
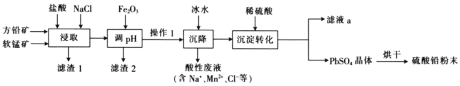
已知:i.PbCl2难溶于冷水,易溶于热水。
ii.PbCl2(s)+2Cl-(aq) PbCl42-(aq) ΔH>0
PbCl42-(aq) ΔH>0
iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5。
(1)“浸取”时需要加热,此时盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为__。
(2)“调pH”的目的是__。
(3)“沉降”操作时加入冰水的作用是__。
(4) 时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随着HCl浓度的增大,PbCl2溶解量减小是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(5)PbCl2经“沉淀转化”后得到PbSO4,当c(Cl-)=0.1mol·L-1时,c(SO42-)=__。
(6)“滤液a”经过处理后可以返回到__工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂三盐基硫酸铅(3PbO·PbSO4·H2O),该反应的化学方程式为__。
-
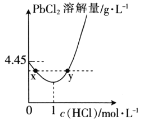
硫酸铅( PbSO4) 广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为 PbS, 含有FeS2等杂质)和软锰矿(主要成分为MnO2 ) 制备PbSO4的工艺流程如图:
已知:
i. PbCl2难溶于冷水,易溶于热水
ii. PbCl2 (s) + 2 Cl- ( aq )  PbCl42-( aq ) △H> 0
PbCl42-( aq ) △H> 0
iii.Ksp(PbSO4) =1. 08 ×10-8 , Ksp(PbC12) = 1. 6× 10 -5
(1)“浸取”过程中盐酸与MnO2 、P bS 发生反应生成PbCl2和S 的化学方程式为______________,加入NaCl 的目的是__________________。
(2)沉降操作时加入冰水的作用是_______________________。
(3) 20°C 时 ,PbCl2 ( s) 在不同浓度盐酸中的最大溶解量( g • L-1 ) 如图所示。下列叙述正确的是_____________(填字母)
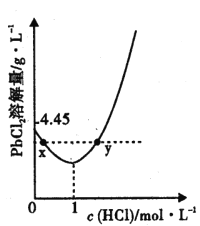
A. 盐酸浓度越小,Ksp(PbC12)越小
B.x、y 两点对应的溶液中c( Pb2+ )不相等
C 当盐酸浓度为1 mol• L-1 时,溶液中c( Pb2+)一定最小
D. 当盐酸浓度小于1 mol• L-1时 ,随 HCl 浓度增大,P bCl2 溶解量减少是因为 Cl-浓度增大使 PbCl2溶解平衡逆向移动
(4)调 pH 的目的是__________,PbC12 “转化”后得到 PbSO4, 当c (Cl-)= 0.100mol/L 时 ,c( SO42-) =________________。
(5)滤液 a 经过处理后可以返回到______工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂--三盐基硫酸 (3 PbO•PbSO4•H2O) ,写出该反应的化学方程式 _____________________.
-
PbCO3可用于油漆、陶瓷和玻璃等工业。由方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2)制备PbCO3的流程如下:

已知:PbCl2难溶于冷水和乙醇,易溶于热水;各物质的溶度积见下表。试回答下列问题:
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | PbCl2 | PbS | PbCO3 |
| Ksp | 2×10-13 | 8.0×10-16 | 1×10-38 | 1.6×10-5 | 8.0×10-28 | 7.4×10-14 |
(1)PbCO3的名称是________。
(2)步骤①中MnO2的作用是________,根据下图分析①的最佳反应条件是________。
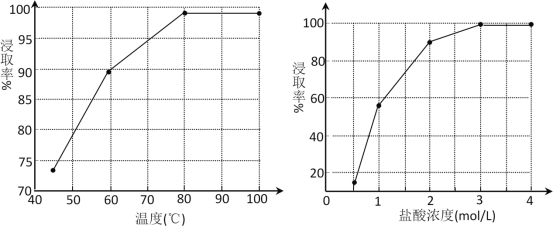
(3)步骤②趁热抽滤的原因是___________________。
(4)步骤③洗涤用的试剂是____________。
(5)将滤液Y先酸化,然后加入MnO2,反应的离子方程式为__________;若反应后c(Mn2+)=0.2mol/L,进一步调节溶液的pH可分离Fe3+和Mn2+,溶液所调的pH范围为_______[c(Fe3+)≤1×10-5 mol/L时表示Fe3+已沉淀完全]。
(6)步骤④反应的离子方程式为______________。
(7)样品PbCO3中有少量PbCl2杂质,提纯的实验方案是________。
-
四氧化三锰(Mn3O4)是电子工业的磁性材料,而氯化铅(PbCl2)常用于焊料和助溶剂、制备其他铅盐等。用方铅矿精矿(主要成分为PbS)和软锰矿(主要成分是MnO2,还含有Fe2O3、Al2O3等杂质)制备PbCl2和Mn3O4的工艺流程如下:

已知:PbCl2(s) + 2Cl-(aq)  PbCl42- ( aq) ΔH > 0
PbCl42- ( aq) ΔH > 0
(1)80℃时,为提高方铅矿精矿、软锰矿与盐酸反应的速率,可采取的措施有________(写出一条即可)。
(2)试剂X是___________。(填“化学式”)
(3)用盐酸处理两种矿石粉末,生成MnCl2、PbCl2和S的总反应化学方程式为___________。
(4)结合化学用语回答,向酸浸液中加入饱和食盐水的目的是___________。
(5)向滤液b中通入NH3和O2发生反应后,总反应的离子方程式为___________。
(6)金属锰可以用Mn3O4为原料,通过铝热反应来制备,当生成5.5 kg Mn 时,理论上消耗金属铝的质量最少为___________kg。
-
工业上应用两矿法浸出软锰矿(主要成分MnO2)和方铅矿(主要成分PbS、FeS2),制备PbSO4和Mn3O4,转化流程如下。
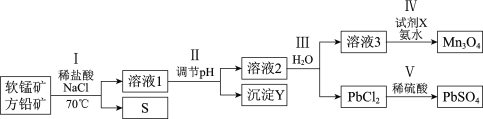
已知:PbCl2微溶于水,溶液中存在可逆反应: 。
。
下列说法正确的是
A.Ⅰ中可使用浓盐酸代替稀盐酸和NaCl的混合溶液
B.Ⅱ中生成的沉淀Y是Fe(OH)2
C.Ⅳ中试剂X可能作氧化剂
D.Ⅴ中发生反应:Pb2++SO42-== PbSO4
-
铅单质及其化合物在新能源领域应用广泛,工业上利用方铅精矿(主要成分为PbS)制备PbSO4的工艺流程如下:
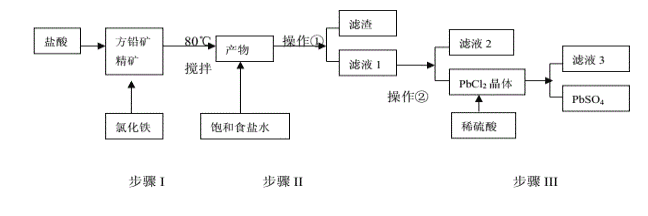
已知:①PbCl2(s)+2Cl-(aq) PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
(1)步骤Ⅰ中发现有淡黄色沉淀生成,请写出离子反应方程式:_______________________;
(2)步骤Ⅰ原料预处理过程中写出一种除搅拌外加快反应速率的办法:_________________;反应温度不宜过高,且需加入过量盐酸保证溶液呈强酸性,原因是:____________________;
(3)操作①应为:_______ ;操作②应为:_________ ;
A、趁热过滤 B、蒸发浓缩,冷却结晶; C、蒸发结晶 D、重结晶
(4)写出步骤III中PbCl2生成PbSO4的离子反应方程式:___________________________ ,该反应的平衡常数K=_______;
(5)铅蓄电池(Pb-PbO2-H2SO4)充电时的阳极反应方程式:_________________________ ;
(6)某铅蓄电池放电时电流为0.2A,可持续放电时间96500s,此时参加反应的Pb的质量为41.4g,求该电池放电的能量转化率α=_________ 。(电池能量转化率的定义:α=实际输出电量/理论输出电量×100%,结果保留两位有效数字,已知法拉第常数为96500C/mol)
-
用方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,Al2O3等杂质) 制备PbSO4和Mn3O4的工艺流程如下:
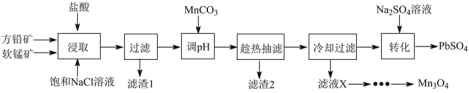
已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2 (s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3•H2O=2Mn3O4↓+12NH4Cl+6H2O
④部分金属离子开始沉淀和沉淀完全的pH如下(开始沉淀的pH按金属离子浓度为0.1mol·L−1计算)。
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
| 开始沉淀的pH | 7.6 | 2.7 | 4.0 | 7.7 |
| 沉淀完全的pH | 9.6 | 3.7 | 5.2 | 9.8 |
(1)“浸取”需控制温度在80℃左右,为加快酸浸速率,还可采用的方法是______。
(2)加入饱和NaCl溶液的目的是______。
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为______。
(4)用MnCO3调节溶液pH的范围为______。
(5)“趁热抽滤”的目的是______。
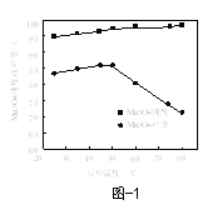
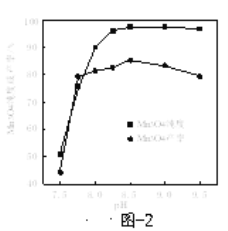
(6)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图−1、图−2所示,请补充完整由滤液X制备Mn3O4的实验方案:______,真空干燥4小时得产品Mn3O4。(实验中须使用的试剂:氨水、空气)

PbCl42-(aq) △H>0

















