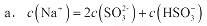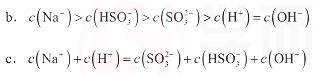-
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
| n(SO32﹣):n(HSO3﹣) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显 性。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如图:
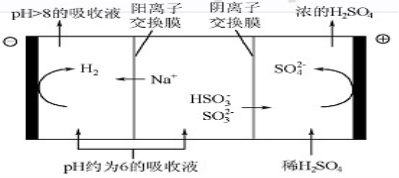
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理: 。
-
(10分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示S形成硫酸酸雨的反应方程式 , 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________。
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣),n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):,n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
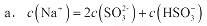
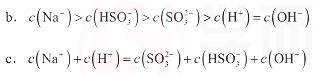
(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用。简述再生原理:
。
-
(13分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO₃²﹣):n(HSO₃﹣) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
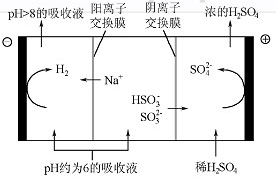
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
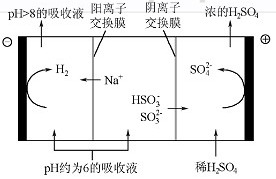
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
-
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是______.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:______.
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):______.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
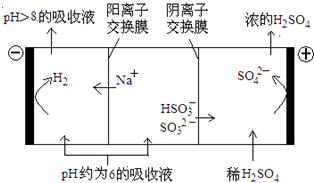
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
①HSO3-在阳极放电的电极反应式是______.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:______.
-
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO₃²﹣):n(HSO₃﹣) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
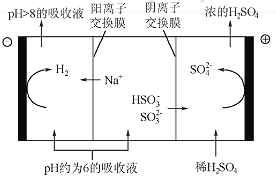
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
-
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO₃²﹣):n(HSO₃﹣) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
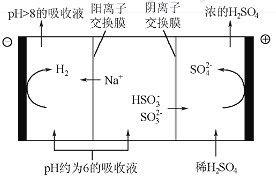
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
-
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示S形成硫酸酸雨的反应方程式______,______.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是______.
(3)吸收液吸收SO2的过程中,pH随n(SO32-),n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:______.
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):______.
a、c(Na+)=2c(SO32-)+c(HSO3-)
b、c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
c、c(Na+)+c(H-)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如图:
①HSO3-在阳极放电的电极反应式是______.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:______.
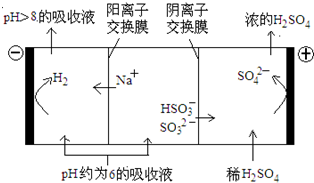
-
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示S形成硫酸酸雨的反应方程式______,______.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是______.
(3)吸收液吸收SO2的过程中,pH随n(SO32-),n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:______.
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):______.
a、c(Na+)=2c(SO32-)+c(HSO3-)
b、c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
c、c(Na+)+c(H-)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如图:
①HSO3-在阳极放电的电极反应式是______.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:______.
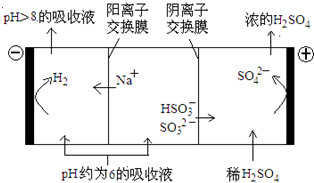
-
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:_________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是____________________。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如下表所示:
| n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释__________________。
②当吸收液呈中性时,下列溶液中离子浓度关系正确的是(选填字母)________。
a. c(Na+)=2c(SO32-)+c(HSO3-)
b. c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c. c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
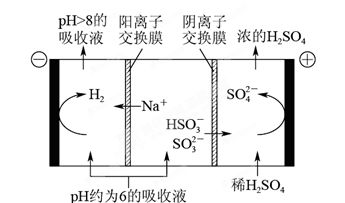
① HSO3-在阳极放电的电极反应式是 。
② 当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理_______________。
-
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是____________________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如下表:
| n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012·福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是________(填序号)。
HSO3-+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去