-
弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
| Ka1 | Ka2 |
| HA | 1×10-4 | |
| H2B | 1×10-2 | 5×10-6 |
①25℃时,0.100mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是:___。pH=8的NaA溶液中由水电离出的c(OH-)=___mol·L-1。
②25℃时,0.100mol·L-1的NaHB溶液pH___7,理由是___。
③25℃时,向0.100mol·L-1的Na2B溶液中滴加足量0.100mol·L-1的HA溶液,反应的离子方程式为___。
(2)已知25℃时,向0.100mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
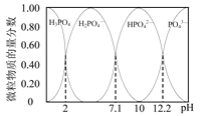
①当溶液pH由11到14时,所发生反应的离子方程式为:___。
-
弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
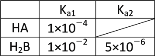
①25℃时,0.100 mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是: _______ 。pH=8的 NaA溶液中由水电离出的c(OH-)= _______ mol·L-1。
②25℃时,0.100 mol·L-1的NaHB溶液pH _______ 7,理由是 _______ 。
③25℃时,向0.100 mol·L-1的Na2B溶液中滴加足量0.100 mol·L-1的HA溶液,反应的离子方程式为_______ 。
(2)已知25℃时,向0.100 mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
①25℃,pH=3时溶液中c(H3PO4)∶c(H2PO )=_______ 。
)=_______ 。
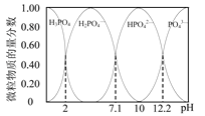
②当溶液pH由11到14时,所发生反应的离子方程式为:_______ 。
-
已知常温下,HA的电离平衡常数Ka=6.25×10-5,H2CO3的电离平衡常数Ka1=4.17×10-7、Ka2=4. 90×10 -11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法不正确的是(不考虑饮料中其他成分)
A. 相同物质的量浓度的NaA、HA混合溶液呈碱性
B. 提高CO2兖气压力,碳酸饮料中c (A-)减小
C. 当碳酸饮料的pH为5.0时,
D. 碳酸饮料中各粒子的浓度关系为c( H+) =c( HCO3-)+2c( CO32-) +c(OH-) -c(HA)
-
已知常温时下列物质的电离平衡常数和沉淀溶解平衡常数
| HA | H2B | HC | MOH | H2O |
| Ka | Ka1 | Ka2 | Ka | Kb | Kw |
| 数值 | 1.8×10-5 | 4.3×10-7 | 5.6×10-11 | 4.9×10-10 | 1×10-6 | 1×10-14 |
(1)在等浓度的NaA、NaHB混合溶液 中c(A-)________ c(HB-)(填“>”、“<”或“=”)
(2)判断下列反应能发生的是________
A.HA+HB-(少量)=A-+H2B B.H2B(少量)+C-=HB-+HC C.HA(少量)+C-=A-+HC
(3)常温时,当MOH和盐酸混合恰好中和生成0.1mol•L-1MCl稀溶液,已知溶液的PH为4,则该溶液中MOH的平衡浓度为________mol•L-1.
-
下表是25℃时三种弱酸的电离平衡常数:
| 化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
| Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因____________________。
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为____________。
(3)25℃时,等物质的量浓度的HA和NaA的混合溶液呈碱性,则该混合溶液中各离子浓度大小关系为________________,解释混合溶液呈碱性的原因_________________________________。
(4)写出NaA溶液中通少量CO2的离子方程式_______________________________________。
(5)某同学用Na2CO3和NaHCO3溶液进行如下图所示实验:

① 充分反应后a试管中大量存在的离子是_______________________________________。
② 用离子方程式表示b试管中发生的反应_______________________________________。
-
下表为25℃的三种弱酸的电离平衡常数:
| 化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
| Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因_________________________。
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为_______________。
(3)写出NaA溶液中通少量CO2的离子方程式____________________。
(4)现有Na2CO3和NaHCO3两种白色固体物质,欲探究Na2CO3和NaHCO3稳定性的相对强弱,设计了以下实验:
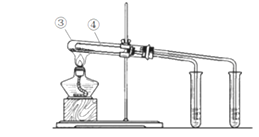
①如上图所示,试管④中装入的固体应该是_________(填化学式)。
②通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性更_______(填“强”或“弱”)。
-
部分弱电解质的电离平衡常数如下:
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=1.8×10-5 |
下列说法错误的是( )
A. 结合H+的能力:CO32->CN->HCO3->HCOO-
B. 0.1mol/L的HCOONH4溶液中存在以下关系式:c(HCOO-)>c(NH4+)>c(H+)>c(OH-)
C. pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则V(盐酸)>V(氨水)
D. 等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者等于后者
-
已知25 ℃时部分弱电解质 的电离平衡常数数据如表所示,回答下列问题:
的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 |  HClO HClO
|
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1 mol·L-1的下列四种溶液,pH由小到大排列的顺序是 (用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填字母)。
A.c(H+)
B.
C.c(H+)·c(OH-)
D.
E.
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式 。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)= (填准确数值)。
(5)25℃时,将a mol·L-1的醋酸与b mol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为_________。
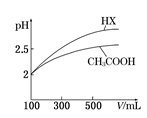
(6)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离平衡常数___________(填“>”、”=”或“<”)CH3COOH的电离平衡常数。
(7)标准状况下,将1.12 L CO2通入100 mL 1 mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+_____________________。
②c(H+)+c(Na+)=________________________。
-
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1mol•L﹣1的四种溶液:pH由小到大排列的顺序是___________(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol•L﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_________(填字母)
A. c(H+) B.  C. c(H+)•c(OH﹣)
C. c(H+)•c(OH﹣)
D.  E.
E. 
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=________(填准确数值).
(5)25℃时,将a mol•L﹣1的醋酸与b mol•L﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_________________
(6)标准状况下,将1.12L CO2通入100mL 1mol•L﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+______________
-
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____(填字母)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c(OH-)/c(H+) E.
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________。
(4)25℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_____。
(5)标准状况下,将1.12L CO2通入100mL 1mol/L的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH-)=2c(H2CO3)+___。
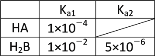
)=_______ 。




