-
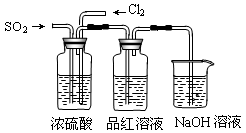
某化学实验小组为了验证SO2和Cl2的漂白性,设计了如下图所示的实验装置。请回答下列问题:
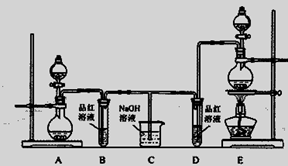
(1)他们制备SO2和Cl2所依据的原理分别是:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑、MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是________
MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是________
(填序号),反应中盐酸所表现的性质是________;
(2)反应开始后,发现B、D试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的溶液加热,B试管中的现象是________;
(3)装置C的作用是________;
(4)NaOH(足量)溶液分别与两种气体反应的离子方程式是________、________;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1∶1混合,再与水反应可生成两种常见酸,因而失去漂白作用。该反应的化学方程式为。
-
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。请回答下列问题:
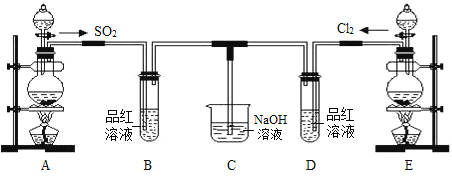
(1)实验室用装置E制备Cl2,其反应的化学方程式为MnO2+4HCl(浓)  MnCl2 + Cl2↑ + 2H2O。将上述化学方程式改写为离子方程式_______________________________。
MnCl2 + Cl2↑ + 2H2O。将上述化学方程式改写为离子方程式_______________________________。
(2)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现__________的现象(填选项序号,下同)。
A.品红溶液都褪色 B.品红溶液都不褪色
C.B中品红溶液褪色,D中不褪色 D.D中品红溶液褪色,B中不褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的溶液呈现的颜色分别为________。
A.无色、红色 B.无色、无色 C.红色、红色 D.红色、无色
(3)C烧杯中氢氧化钠溶液的作用是_____________________________,写出Cl2通入NaOH溶液中的化学方程式_______________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按物质的量之比1︰1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请分析该现象的原因(用离子方程式表示)_______________________________________。
-
某化学实验小组为了验证SO2和C12的漂白性,设计了如图所示的实验装置:
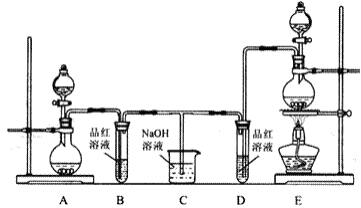
(1)已知制备SO2的原理为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,使用A装置;制备Cl2采用实验室制法,反应方程式为_______________。
(2)E装置中盛放浓盐酸的仪器为_________,作用为_________;
(3)反应开始后,发现B、D试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的溶液加热,B、D试管中的现象是_________。
(4) 装置C的作用是_________。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见酸,因而失去漂白作用。该反应的化学方程式为_________。
-
某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。
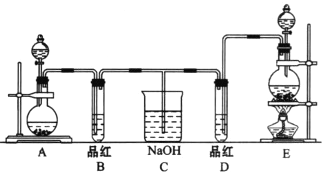
(1)实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中______装置(填装置序号)制Cl2,在制Cl2的反应中浓盐酸所表现出的性质是______.
(2)应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:________, D:_________.
(3)装置C的作用是__________。
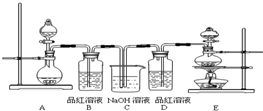
(4)甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性,试分析:
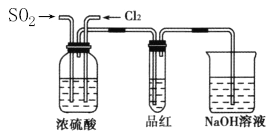
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是____________。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色。其原因是 ,并写出其相应的离子方程式:_________.
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅。其原因________
-
某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
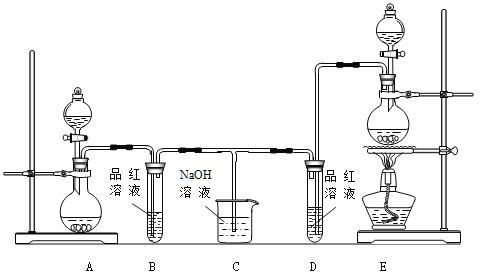
(1)他们制备Cl2依据的原理是:MnO2+ 4HCl(浓) MnCl2+ 2H2O + Cl2↑,应选用上图A、E装置中的_____(填序号)制Cl2,反应中浓盐酸所表现出的性质是__________、__________。
MnCl2+ 2H2O + Cl2↑,应选用上图A、E装置中的_____(填序号)制Cl2,反应中浓盐酸所表现出的性质是__________、__________。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是__________________________。
(3)NaOH溶液分别与两种气体反应的离子方程式是___________、_________。
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是_________________。
-
某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
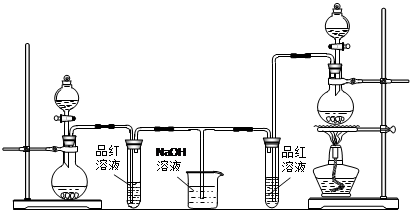
A B C D E
(1)实验室制备Cl2依据的原理是(化学方程式):________ ,应选用上图A、E装置中的________(填序号)制Cl2,反应中浓盐酸所表现出的性质是________、________。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是。
(3)NaOH溶液与Cl2反应的离子方程式:________。
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是________。
-
(6分)某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
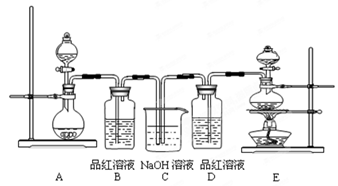
(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是__________。
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,现象分别为:B ,D_________________。
(3)装置C的作用是________________________________。
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
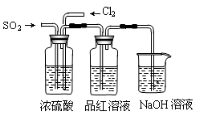
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):________________。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?_____________________________。
-
(10分)某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
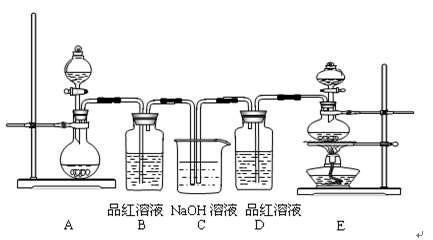
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质是______、_______。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:B ________, D_________________。
(3)装置C的作用是________________________________。
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
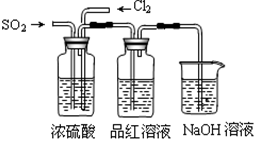
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是:
________。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
________
-
(10分)某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
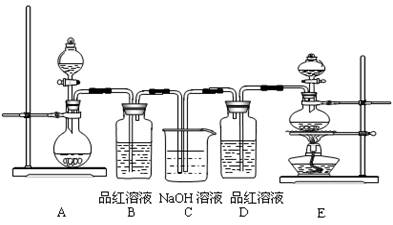
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质______、_______。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:B ________, D_________________。
(3)装置C的作用是________________________________。
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是:________
________。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
________
-
某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质______,______
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:
B______ D______
(3)装置C的作用是______
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,试根据该实验装置和两名同学的实验结果
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸的两个目的______、______.
②试分析甲同学实验过程中,品红溶液不褪色的原因是:______、______,并用离子方程式表示______、______
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?______.

MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是________













