-
绿矾(FeSO4•7H2O)是中学阶段常用的一种还原剂。
(1)久置的绿矾溶液容易被空气氧化变质,简述检验绿矾溶液已经变质的操作和现象:取少量待测液于试管中, 。
(2)绿矾溶液浓度的标定测定溶液中Fe2+物质的量浓度的方法是:
a.量取25.00mL待测溶液于锥形瓶中;
b.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点;
c.重复操作2次,消耗KMnO4溶液体积的体积分别为20.02mL、24.98mL、19.98mL。
(已知滴定时发生反应的离子方程式为5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①判断此滴定实验达到终点的方法是 。
②计算上述滤液中Fe2+物质的量浓度 (保留四位有效数字)。
(3)探究保存绿矾溶液的有效措施
【反应原理】Fe2+在空气中易氧化变质,完成并配平下列离子方程式:
Fe2+ + O2 + = Fe(OH)3↓+ Fe3+
【操作与现象】取4支试管,如图进行实验,请在相应位置上写出试管①的现象和④的添加试剂。
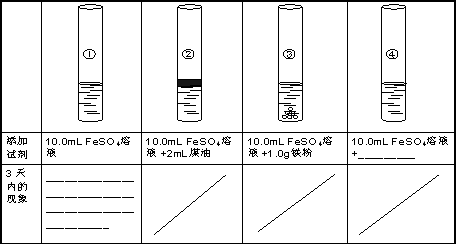
【分析与结论】设计试管①的作用是 ;为了有效保存FeSO4溶液,你认为最佳方案为 。
-
Ⅰ.铁是人体必需的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是 ;实验室在配制FeSO4溶液时常加入 以防止其被氧化。请你设计一个实验证明FeSO4溶液是否被氧化 。
Ⅱ.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(2)硫酸亚铁铵不易被氧化的原因是 。
(3)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
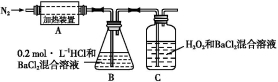
①A中固体充分加热较长时间后,通入氮气,目的是 。
②装置B中BaCl2溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的现象为 。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)。
-
Ⅰ.铁是人体必需的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是__________;实验室在配制FeSO4溶液时常加入____以防止其被氧化。请你设计一个实验证明FeSO4溶液是否被氧化__。
Ⅱ.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(2)硫酸亚铁铵不易被氧化的原因是______________________。
(3)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
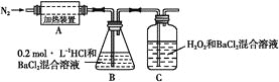
①A中固体充分加热较长时间后,通入氮气,目的是_____________________________。
②装置B中BaCl2溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的现象为_。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为___________ (用离子方程式表示)。
-
I.铁是人体必须的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成份。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是________;实验室在配制FeSO4溶液时常加入________以防止其被氧化,请你设计一个实验证明FeSO4溶液是否被氧化________。
(2)测定绿矾样品含量的实验步骤:
a. 称取5.7g样品,溶解,配成250mL溶液
b.量取25mL待测溶液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL
根据以上步骤回答下列问题:
①用硫酸酸化的KMnO4滴定终点的标志是________。
②计算上述产品中FeSO4·7H2O的质量分数为________。
II.硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(3)硫酸亚铁铵不易被氧化的原因________。
(4)为检验分解产物的成份,设计如下实验装置进行实验,加热A中硫酸亚铁铵至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是________。
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的观象为________。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为________(用离子方程式表示)
-
(2014•抚州模拟)下列说法正确的是( )
A.根据反应5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4•7H2O)是否变质
B.根据反应H3PO3+2NaOH(足量)═Na2HPO3+2H2O可知:H3PO3属于三元酸
C.根据反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O可知:反应中HNO3表现酸性和氧化性
D.根据反应CuSO4+H2S═CuS↓+H2SO4可知:H2S的酸性比H2SO4强
-
下列说法正确的是( )
A.根据反应5Fe2++MnO4ˉ+8H+=5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4·7H2O)是否变质
B.根据反应Fe+4HNO3=Fe(NO3)2+2NO↑+2H2O可知:反应中HNO3表现酸性和氧化性
C.根据反应CuSO4+H2S=CuS↓+H2SO4可知:H2S的酸性比H2SO4强
D.根据反应H3PO3+2NaOH(足量)=Na2HPO3+2H2O可知:H3PO3属于三元酸
-
下列说法正确的是( )
A.根据反应5Fe2++MnO4ˉ+8H+=5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4·7H2O)是否变质
B. 根据反应3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O可知:反应中HNO3表现酸性和氧化性
C. 根据反应CuSO4+H2S=CuS↓+H2SO4可知:H2S的酸性比H2SO4强
D. 根据反应H3PO3+2NaOH(足量)=Na2HPO3+2H2O可知:H3PO3属于三元酸
-
下列说法正确的是( )
A.根据反应5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4•7H2O)是否变质
B.根据反应H3PO3+2NaOH(足量)═Na2HPO3+2H2O可知:H3PO3属于三元酸
C.根据反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O可知:反应中HNO3表现酸性和氧化性
D.根据反应CuSO4+H2S═CuS↓+H2SO4可知:H2S的酸性比H2SO4强
-
下列说法正确的是( )
A.根据反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4·7H2O)是否变质
B.根据反应H3PO3+2NaOH(足量)===Na2HPO3+2H2O可知:H3PO3属于三元酸
C.根据反应3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O可知:反应中HNO3表现酸性和氧化性
D.根据反应CuSO4+H2S===CuS↓+H2SO4可知:H2S的酸性比H2SO4强
-
下列说法正确的是
A.根据反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4·7H2O)是否变质
B.根据反应H3PO3+2NaOH(足量)===Na2HPO3+2H2O可知:H3PO3属于三元酸
C.根据反应3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O可知:反应中HNO3表现酸性和氧化性
D.根据反应CuSO4+H2S===CuS↓+H2SO4可知:H2S的酸性比H2SO4强



