-
化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳。而氢气和氮气都被认为是无碳无污染的清洁能源。
I. “氢能”将是未来最理想的新能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M+xH2=MH2x △H<0 (M表示某种合金)
下图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。

则下列说法中,正确的是_______。
a. T1>T2
b.增大M的量,上述平衡向右移动
c.增大氢气压强,加快氢气的吸收速率
d.金属储氢过程中M做还原剂,价态升高
(2)工业上通常用生产水煤气的方法制得氢气。其中C(s)+H2O(g)=CO(g)+H2(g),在850℃时平衡常数K=1。若向1L的恒容密闭真空容器中同时加入xmolC和6.OmolH2O。
①850℃ 时反应达到平衡,x应满足的条件是____________。
②对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的是_______。
a.选用更高效的催化剂 b.升高温度
c.及时分离出氢气 d.增加氢气的浓度
II. CO2是合成尿素的原料
现在以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体。乙装置中a、b为石墨,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL。
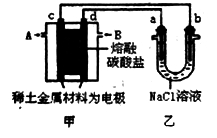
工作过程中,甲装置中d电极的电极反应式是___________,乙装置中电极a为_____极(填电极名称)。
(2)若在a极产生112mL(标准状况)气体,25℃时乙装置中所得溶液pH =_______(忽略电解前后溶液体积变化)
III.氨是制备尿素的原料,NH3、N2O4等在工农业生产,航天航空等领域有广泛应用。
(1)氨在氧气中燃烧,生成水和一种空气组成成分的单质。已知:N2(g)+3H2(g) 2NH3(g)△H =-92.4kJ/mol及H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:__________________。
2NH3(g)△H =-92.4kJ/mol及H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:__________________。
(2)氨气溶于水得到氨水,在25℃ 下,将a mol·L-1的氨水和b mol·L-1的硫酸以3:2的体积比混合,反应后溶液呈中性。用含a和b的代数式表示出NH3 H2O的电离平衡常数________。
-
化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳。而氢气和氮气都被认为是无碳无污染的清洁能源。
Ⅰ.“氢能”将是未来最理想的新能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为M(s)+xH2═MH2x(s) △H<0(M表示某种合金)。图甲表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。
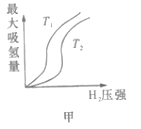
下列说法中正确的是___(填字母代号)。
a.T1>T2
b.增大M的量,上述平衡向右移动
c.增大氢气压强,加快氢气的吸收速率
d.金属储氢过程中M作还原剂,价态升高
(2)工业上通常用生产水煤气的方法制得氢气。其中C(s)+H2O(g) CO(g)+H2(g) △H>0,在850℃时平衡常数K=1。若向1L的恒容密闭真空容器中同时加入xmolC和6.0molH2O。
CO(g)+H2(g) △H>0,在850℃时平衡常数K=1。若向1L的恒容密闭真空容器中同时加入xmolC和6.0molH2O。
①850℃时反应达到平衡,x应满足的条件是_____。
②对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的是____(填字母代号)。
a.选用更高效的催化剂
b.升高温度
c.及时分离出氢气
d.增加氢气的浓度
Ⅱ.CO2是合成尿素的原料。
现以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置乙所示),其中负极通入H2,正极通入O2和CO2的混合气体。装置丙中a、b为石墨,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL。
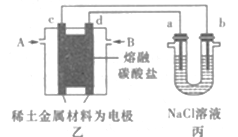
(1)工作过程中,装置乙中电极c为____(填电极名称)极。
(2)若在a极产生112mL(标准状况)气体,25℃时丙装置中所得溶液pH=____(忽略电解前后溶液体积变化,不考虑气体的溶解)。
Ⅲ.氨是制备尿素的原料。NH3、N2O4等在工农业生产、航天航空等领域有广泛应用。
(1)氨在氧气中燃烧,生产水和一种空气组成成分的单质。已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol,H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:________________________。
2NH3(g) △H=-92.4kJ/mol,H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:________________________。
(2)氨气溶于水得到氨水,在25℃下,将amol·L-1的氨水和bmol·L-1的硫酸溶液以3:2的体积比混合,反应后溶液呈中性。用含a和b的代数式表示出NH3·H2O的电离平衡常数:___________。
(3)用氨水除去SO2,已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中离子浓度从大到小的关系是_________________。
-
Ⅰ.化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳, 而氢气被认为是无碳无污染的清洁能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M+xH2 MH2x △H<0 (M表示某种合金)右图表示温度分别为T1, T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是 。
MH2x △H<0 (M表示某种合金)右图表示温度分别为T1, T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是 。

a、T1>T2
b、增大氢气压强,加快氢气的吸收速率
c、增大M的量,上述平衡向右移动
d、上述反应可实现多次储存和释放氢气
(2)在25℃,101KPa条件下,ag氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 .
(3)工业上通常用生产水煤气的方法制得氢气。其中C(s) +H2O(g)  CO(g) + H2(g) ,在850℃时平衡常数K= 1.若向1升的恒容密闭真空容器中同时加入x mol C和6.0mol H2O.
CO(g) + H2(g) ,在850℃时平衡常数K= 1.若向1升的恒容密闭真空容器中同时加入x mol C和6.0mol H2O.
①当加热到850℃,反应达到平衡的标志有 .
A.消耗水蒸气的物质的量与生成CO的物质的量相等 B.容器内的压强不变
C.混合气的密度不变 D.单位时间有n个H﹣O键断裂的同时有n个H﹣H键断裂
②850℃时反应达到平衡,x应满足的条件是 .
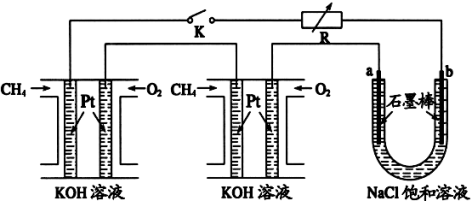
Ⅱ、甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题
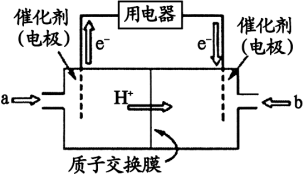
(4)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如上图所示:通入b气体的电极是原电池的 极(填 “正”或“负”)。通入a气体的电极反应式为 。
(5)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示U形管中氯化钠溶液的体积为80ml。闭合K后,若每个电池甲烷用量均为0.224L(标况),且反应完全,则理论上通过电解池的电量为 (保留两位小数,已知法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 。
-
有关能源的说法不正确的是( )
A. 氢能、核能均是无污染的高效能源 B. 公共汽车大部分采用天然气作为燃料可减少对大气的污染
C. 把煤转化为液态燃料可提高煤的燃烧效率 D. 化石能源是非再生能源
-
能源与可持续发展密切相关。下列说法正确的是( )
A.直接开采的化石燃料完全燃烧不会造成大气污染
B.从海洋中开采的“可燃冰”释放出的气体与天然气成分相同
C.二氧化碳、水通过人工光合作用生成有机物同时放出能量
D.“干热岩体”(温度大于200℃高温岩体)能源属于化石能源
-
下列说法不正确的是( )
A. 煤和石油燃烧不完全时可排放出大量烟尘和CO
B. 化石燃料燃烧排出废气中含SO2,直接排到大气中会污染空气并形成酸雨
C. 可通过物理方法把化石燃料转化为洁净燃料
D. 氢能、核能、太阳能等都属于洁净、高效的新能源
-
下列关于化石燃料的说法不正确的是
A.化石燃料的不完全燃烧是引起大气污染的主要原因之一
B.如果化石燃料能够完全燃烧就不会造成大气污染
C.燃料燃烧的产物CO2是一种温室气体
D.以液化石油气代替燃油可以减少大气污染
-
下列有关燃料的说法错误的是
A.燃料燃烧产物CO2是温室气体之一
B.化石燃料完全燃烧不会造成大气污染
C.以液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的CO是大气污染物之一
-
下列有关燃料的说法错误的是( )
A. 燃料燃烧产物CO2是温室气体之一
B. 化石燃料完全燃烧不会造成大气污染
C. 以液化石油气代替燃油可减少大气污染
D. 燃料不完全燃烧排放的CO是大气污染物之一
-
下列有关燃料的说法错误的是
A.燃料燃烧产物CO2是温室气体之一
B.化石燃料完全燃烧不会造成大气污染
C.以液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的CO是大气污染物之一


2NH3(g)△H =-92.4kJ/mol及H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:__________________。




